中枢神经系统的损伤可能造成永久性的感觉和运动功能丧失。如在脊髓损伤后,大脑向脊髓长距离投射的神经轴突断裂,而在中枢神经系统中断裂的轴突无法再生,最终导致了中枢神经永久性的功能性损伤。由于脊髓中的轴突损伤后其在大脑中对应的神经元一般不会死亡,促进轴突再生是一种可能治疗脊髓损伤的研究方向。与中枢神经系统相反,外周神经在损伤后有较强的再生能力,并且能在一定程度上恢复部分功能。神经损伤和修复的过程可以激活免疫系统以及免疫相关的细胞因子, 但目前并不完全清楚这些与免疫相关的信号通路如何影响损伤后的神经元,以及是否能直接促进轴突再生。
2022年11月11日,香港科技大学刘凯课题组在Neuron上发表长文文章Driving Axon Regeneration by Orchestrating Neuronal and Non-neuronal Innate Immune Responses via the IFNγ-cGAS-STING Axis,发现通过在中枢神经系统敲除PTPN2和外加Ⅱ型干扰素可以激活神经元中包括cGAS-STING通路在内的干扰素刺激基因 (interferon stimulated genes, ISGs),从而促进中枢神经系统的轴突再生。

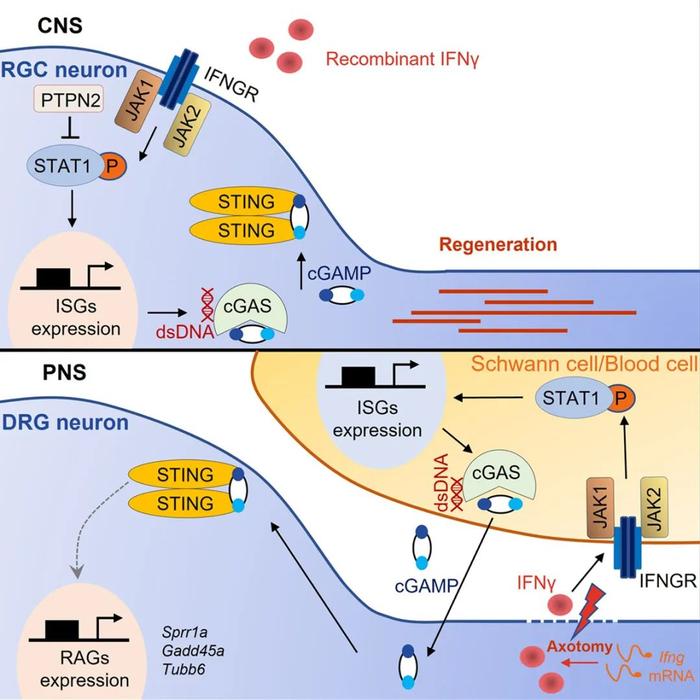
由于之前研究表明一些磷酸酶对于神经轴突再生具有抑制作用,研究人员首先在体外培养的背根神经节(Dorsal root ganglion, DRG)神经元中敲低了84个磷酸酶基因来筛选可能抑制轴突再生的磷酸酶。实验结果发现敲低PTPN2可以显著提升体外培养的DRG神经突的长度。在体内实验中,敲除中枢神经系统的视神经节细胞 (retinal ganglion cell, RGC)的PTPN2也可以在一定程度上增强RGC的轴突再生。由于之前的研究表明PTPN2可以抑制多种细胞因子的激活通路,研究人员继续探究在敲除PTPN2的同时外加细胞因子是否可以进一步增强轴突再生。结果表明敲除PTPN2可以与外加IFNγ协同作用,进一步提升再生的轴突数量和生长速度,其促进再生的作用依赖于神经元的Ⅱ型干扰素受体 (interferon-gamma receptors, IFNGRs) 和STAT1信号通路。在野生型的RGC中,IFNγ注射后其下游的STAT1激活只能维持一天,而PTPN2敲除的神经元中STAT1激活可以维持近一周。将IFNγ-STAT1通路的激活和其他已知的促进轴突再生的信号通路相结合,可以观察到更加快速,更远距离的中枢轴突再生。以上结果说明了在RGC中激活ISG可以促进轴突再生。 研究人员进一步探究了哪一条IFNγ-STAT1的下游通路直接参与轴突再生过程。cGAS-STING是细胞内识别DNA以调节自身免疫的通路。cGAS在结合自身或外源病原体的DNA后开始合成cGAMP (cyclic GMP-AMP),cGAMP可以结合并激活接头蛋白STING从而进一步激活TBK1和IRF3 。视网膜切片的免疫染色表明在PTPN2 KO+IFNγ处理组的RGC中cGAS表达显著升高。PTPN2敲除和神经损伤所造成的DNA损伤激活了RGC中的cGAS。cGAS或STING的敲除抑制了PTPN2 KO+IFNγ造成的轴突再生。向小鼠眼睛玻璃体中直接注射STING激动剂cGAMP也可以直接促进神经再生。这些结果表明cGAS-STING信号通路介导了 PTPN2 KO+IFNγ引发的轴突再生。
研究人员进一步关注了IFNγ-cGAS-STING信号通路是否参与了外周神经的自我修复过程。与中枢神经损伤不同,外周神经会在损伤后通过轴突局部翻译自发地产生IFNγ并释放到损伤区。敲低DRG中的IFNγ或者在损伤区局部注射IFNGR中和抗体都会抑制外周轴突的自发再生。由轴突释放的IFNγ会升高损伤区中雪旺细胞和血细胞的cGAS表达,从而产生cGAMP以促进外周神经的再生。cGAMP可以直接刺激体外培养的DRG神经元的轴突并增强其轴突生长。 综上所述,这一研究表明外周神经轴突可以在损伤后直接调节其损伤环境中的免疫反应以促进自我修复,而在中枢神经系统中人为激活IFNγ-cGAS-STING信号通路也可以促进中枢神经的轴突再生。该研究也提示神经系统损伤后的免疫反应可能同时完成了对抗入侵病原体和促进神经修复两种功能。
此项研究由共同第一作者王续博士和杨超博士,以及美国Purdue大学的Zhong-Yin Zhang教授,香港科技大学的吴若昊教授,钱培元教授,王吉光教授及其他合作者共同完成。
原文链接:
https://doi.org/10.1016/j.neuron.2022.10.028

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有

