导读:
突触丧失是阿尔茨海默病(AD)神经退行性变的最早标志之一,也是与痴呆严重程度最密切的相关因素,但其潜在机制仍很大程度上尚不清楚。临床病理相关性研究表明,并非所有脑中存在β淀粉样蛋白(Aβ)斑块和神经元缠结(NFT)的人在一生中都会不可避免地发生突触和神经元丢失以及痴呆症状,我们将这种现象称为对AD神经病理变化的大脑适应性。与痴呆症患者的大脑相比,同等负荷的Aβ斑块和NFT的适应性大脑显示出突触标志物的保存,而炎性小胶质细胞和星形胶质细胞的变化较少。小胶质细胞或星形胶质细胞的异常反应可能是AD突触丢失和临床疾病表现的主要因素。近期,《JAMA Neurology》期刊发表了题为“Tau Oligomer–Containing Synapse Elimination by Microglia and Astrocytes in Alzheimer Disease”的文章,表明tau寡聚体可以破坏突触功能,并与AD患者的认知障碍密切相关,tau寡聚体在痴呆症患者的大脑突触中异常积聚,但在适应性大脑和对照组的大脑中却没有。其中突触中tau寡聚体的早期积累可作为小胶质细胞或星形胶质细胞吞噬和消除突触的信号。AD中突触丢失和痴呆的潜在驱动因素的时空关系仍然未知,多年来缺乏足够的技术来定量检测和研究单个突触。在这里,作者利用膨胀显微镜(ExM)来评估小胶质细胞和星形胶质细胞,tau寡聚体,突触元件在一组年龄匹配的症状性AD和适应性大脑(Braak阶段III-IV),首次真实地看到了小胶质细胞和星形胶质细胞吞噬突触,还证实了突触丢失导致的认知下降,可能与Aβ斑块和神经纤维缠结无关,在二者出现之前就发生了。证明小胶质细胞、星形胶质细胞和突触tau寡聚体在阿尔茨海默病认知障碍的早期发展过程中发挥着重要作用,围绕着他们或许是改善阿尔茨海默病患者认知的关键疗法。

研究对象
本横断面研究包括40例AD患者,平均死亡年龄(SD)为88岁,其中19例(48%)为女性,21例(52%)为男性(table)(见下表)。
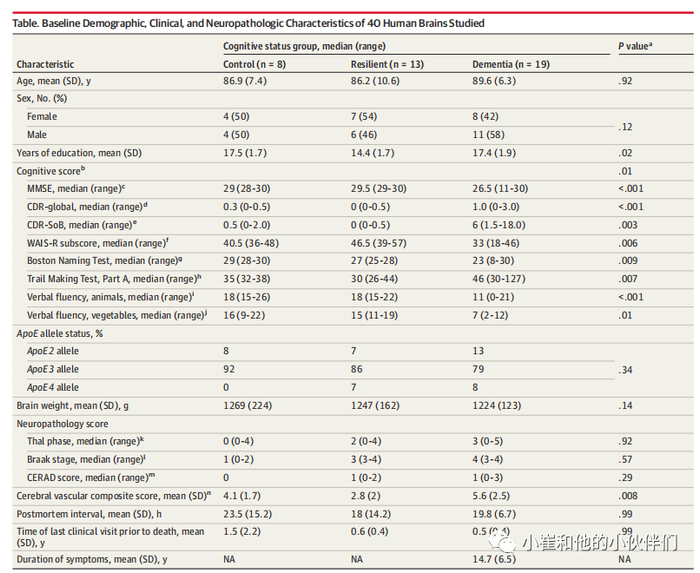
表.研究40例人脑的基线人口统计学、临床和神经病理学特征
结果一:突触丢失的时间
评估痴呆和适应性大脑中多个区域Aβ斑块和NFT负荷的详细定量程序先前已在其他地方发表。Aβ斑块沉积物的负荷,定义为4G 8抗体标记的A β斑块占据的皮质面积(平均值[SD],1.5%[1.7%] vs 2.9%[3.7%];P = 0.60)和神经纤维,定义为AT 8抗体标记的神经突(平均值[SD],0.004%[0.008%]vs0.003%[0.0025%]; P = 0.50)在痴呆大脑和适应性大脑之间的视觉皮层中没有显著差异。正如在Braak III至IV阶段所预期的那样,在适应性大脑或痴呆大脑的视觉皮层中不存在NFT。患有痴呆症的大脑显示出比适应性大脑和对照组大脑更高的血管综合评分。与先前的结果一致,与适应性(168 [165])和对照组(76 [87]; P = 0.001)相比,痴呆患者大脑中每平方毫米γH2AX阳性细胞的平均[SD]数量(508[461])显著增加。与对照组和适应性组的视觉皮层相比,痴呆症组的脑组织中突触前密度下降43%,突触后密度降低33%,突触前和突触后共定位的密度降低38%(图1)。当分析仅限于原发性年龄相关性tau蛋白病患者的较小亚组时,发现了类似的差异,表明无论是否存在A β斑块,在无NFT沉积的情况下,痴呆患者大脑视觉皮层的早期突触丢失都发生了。研究的大脑显示成熟突触的平均(SD)密度为5.6 × 107(1.5 × 107)为适应性脑,3.4× 107(1.05 × 107)为痴呆脑,而原发性年龄相关性tau蛋白病病例亚组的平均(SD)突触密度与5.2 × 107(6.4 × 106)的突触密度相当,原发性年龄相关性tau蛋白病伴痴呆组为3.6 × 107(1.0 × 107),对照组为5.5 × 109/mm3。在之前的研究中,对照组大脑中共定位的成熟点状神经元约占所有点状神经元的65%。在成熟点状神经元和临终前临床痴呆评分-Sum of Boxes之间检测到显著相关性(R =-0.62;P =0 .003),简易精神状态检查评分(R =-0.76;P
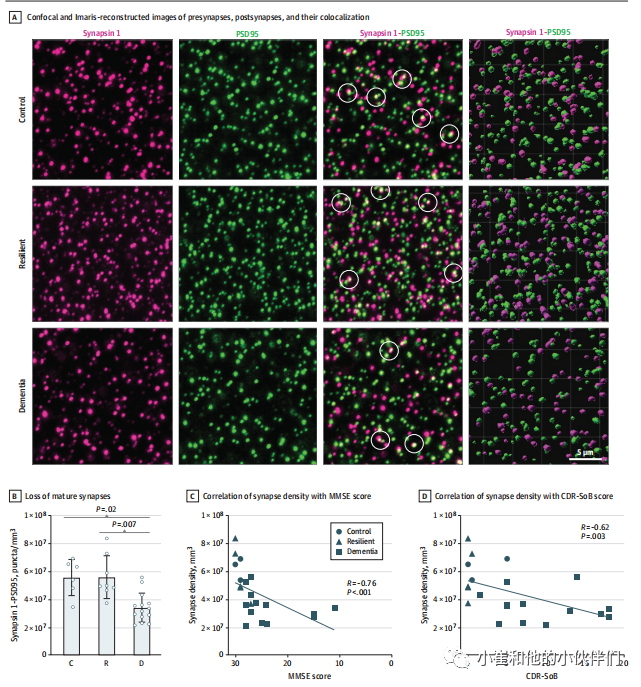
图1.各
组间的突触密度及突触密度与认知测量之间的相关性分析
结果二:小胶质细胞和星形胶质细胞对突触的吞噬
本文所包括的痴呆和适应性大脑中小胶质细胞和星形胶质细胞的促炎性和稳态标记物的详细分析发表在其他地方。Iba 1阳性阿米巴样小胶质细胞内突触点的定量(突触前点状神经元的平均值[SD]为7.7%[2.8%] vs 1.7% [1.2%] vs 1.0% [0.7%]; P (图2)。
为了排除单个星形胶质细胞和小胶质细胞内扩张因子的人为变化,作者使用泛星形细胞胞浆标记物醛脱氢酶1家族成员L1L1(ALDH1L1)和GFAP,以及溶酶体标记物溶酶体相关膜蛋白2(LAMP2)和PSD95。我们发现ALDH1L1标记GFAP阳性和GFAP阴性的星形胶质细胞胞浆,LAMP2和GFAP或IBA1抗体的双重免疫染色令人信服地证明被吞噬的突触点状和溶酶体共存于GFAP阳性的星形胶质细胞和IBA1阳性的小胶质细胞的细胞浆中。
这些结果表明,不仅小胶质细胞,而且星形胶质细胞也能够吞噬人脑中的突触,并且胶质细胞介导的突触过度内化发生在缺乏NFT沉积的情况下,并且可能与早期突触脑功能丧失有关。小胶质细胞和星形胶质细胞介导的突触吞噬在适应性大脑减少可能与这些人的认知保留有关。
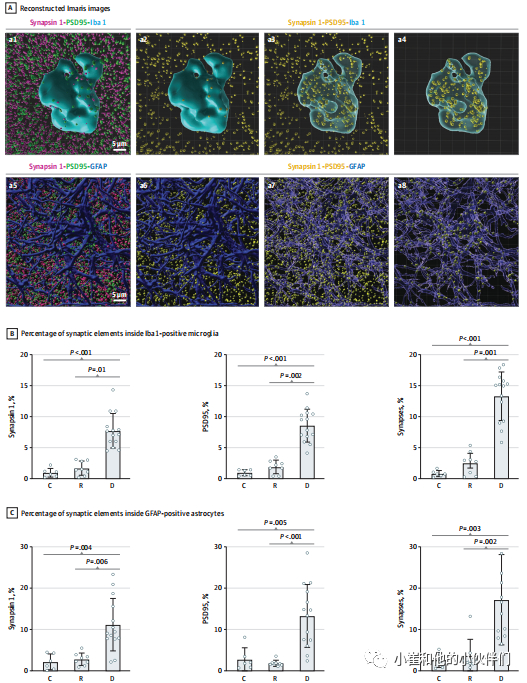
图2.小胶质细胞和星形胶质细胞吞噬突触成分的分析
结果三:Tau蛋白过度磷酸化与Tau寡聚体的突触累积
作者评估了早期tau蛋白过度磷酸化位点,(AT 270/ pTau [Thr 181]、pTau 217 [Thr 217]和AT 180/pTau [Thr 231]),以及总tau(Tau 5)、N-末端tau(Tau 12)和C-末端tau(Tau 46)的水平。在痴呆患者脑内的突触体中,AT 270/Tau 5比值显著增加(中位数[范围],0.27 [0.14-0.40])与适应性组(中位数[范围],0.06 [0.007-0.10])和对照组相比。使用充分表征的抗体TOC 1测量整个组织匀浆和突触体富集部分中的Tau寡聚体。总匀浆中TOC 1的信号强度水平在三组之间没有显著差异,但痴呆患者的大脑中包含显著更高的TOC 1强度(中位数[范围],96147 [82963-109330]相对荧光单位[RFU])(图3)。
这些数据表明,tau蛋白在Thr181的过度磷酸化和突触中TOC1加上tau寡聚体的积累可能是tau蛋白的早期关键病理学修饰,与Braak III至IV期痴呆与适应性个体的突触和认知结果的不同命运相关。
 图3.测量在大脑总匀浆和突触体部分中的寡聚体和高磷酸化的Tau蛋白种类
图3.测量在大脑总匀浆和突触体部分中的寡聚体和高磷酸化的Tau蛋白种类结果四:突触前和突触后隔间中的Tau低聚体
在痴呆患者的大脑中与适应性和对照组相比,与巴松阳性突触前斑点共定位的TOC1阳性tau寡聚体(平均值[SD],49.9% [5.5%] vs 28.2% [6.6%] vs 18.7% [2.3%]; P
结果五:小胶质细胞和星形胶质细胞吞噬含Tau寡聚体的突触
作者通过Iba1阳性阿米巴样小胶质细胞和GFAP阳性星形胶质细胞对10个代表性病例(4个痴呆脑; 4个与Aβ斑块、神经纤维缠结和血管负荷匹配的适应性脑; 2个对照脑)中内化的TOC 1阳性和巴松阳性突触前点以及TOC 1阳性和PSD 95阳性突触后点的比例进行了量化。作者发现在Iba 1阳性的阿米巴样小胶质细胞中,(痴呆组与对照组:7.4% [1.8%] vs 5.1% [1.9%] vs 3.7% [0.8%]; P = 0.006,对于内化TOC1阳性和巴松阳性斑点; 11.6%[3.6%]vs 6.8% [1.3%] vs 7.4% [2.5%]; P = 0.001,对于内化的TOC 1阳性和PSD 95阳性斑点)和GFAP阳性星形胶质细胞(痴呆组与对照组:7.0%[2.1%]vs4.3%[2.6%] vs4.0%[0.7%];P = 0.001,对于内化TOC1阳性和巴松阳性斑点;7.9%[2.2%]vs5.3%[1.8%]vs3.0%[1.5%];P = 0.001,对于内化的痴呆大脑中TOC 1阳性和PSD 95阳性斑点;与适应性大脑相比(图4)。在痴呆患者的脑中,含tau寡聚体的突触点占被小胶质细胞和星形胶质细胞吞噬的总突触点的很大比例(在Iba1阳性的阿米巴样小胶质细胞中,91%的突触前点和93%的突触后点,在GFAP阳性的星形胶质细胞中,63%的突触前点和60%的突触后点),表明含tau寡聚体的突触元件优先被这些脑中吞噬。
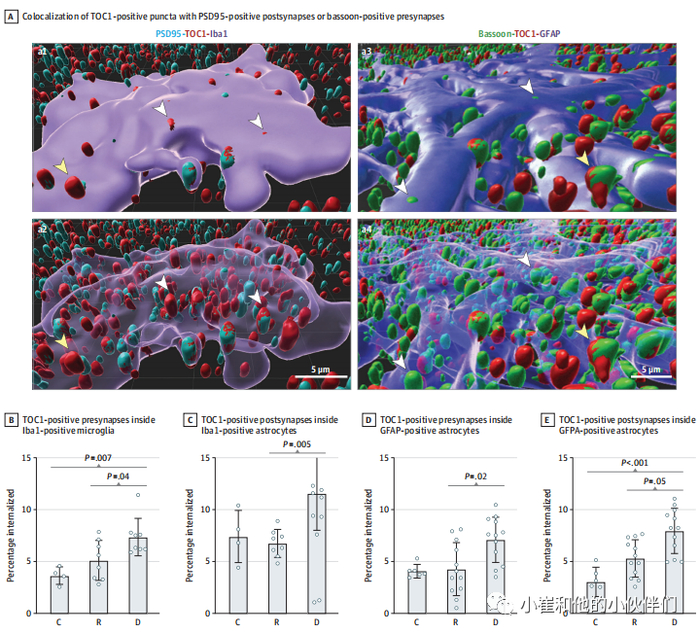
图4.胶质介导的Tau蛋白寡聚物标记突触的吞噬
小结
这项横断面研究的结果表明AD的突触丢失可能主要与小胶质细胞和星形胶质细胞对突触元件的异常吞噬有关,而不是与Aβ斑块或NFT有关,突触中tau寡聚体的异常增加可能是针对突触消除的关键信号,导致脑功能丧失。这些观察结果可能与体内生物标记物的开发有关,这些生物标记物可能更准确地确定大脑中有Aβ斑块和NFT的无症状个体的未来,并指导模仿适应性大脑的新型干预措施,以防止突触中tau寡聚体的积累和阻止神经变性(例如,突触丢失)和痴呆的临床症状。

4001102288 欢迎批评指正
All Rights Reserved 新浪公司 版权所有

