导 读:
大脑中的衰老、tau病理学和慢性炎症在tau蛋白病(包括阿尔茨海默病)的突触丢失、神经变性和认知下降中起着至关重要的作用。衰老细胞在衰老的大脑中积累,同时加速衰老过程,并通过其称为衰老相关分泌表型(SASP)的异常炎症分泌组促进tau蛋白病的进展。Tau低聚物(TauO)——神经毒性最强的Tau类型——已知会诱导衰老和SASP,从而促进神经病理学、炎症、氧化应激、突触功能障碍、神经元死亡和认知功能障碍。TauO、脑部炎症和衰老与TauO病进展和认知能力下降的异质性相关。然而,驱动疾病异质性的潜在机制在很大程度上仍然未知,阻碍了Tau蛋白病疗法的发展。近期,在《Alzheimer's Dementia》期刊发表了题为“Senescence, brain inflammation, and oligomeric tau drive cognitive decline in Alzheimer's disease: Evidence from clinical and preclinical studies”的综述文章。基于临床和临床前证据,这篇综述强调了TauO和衰老在神经变性中的关键作用。作者讨论了针对衰老和TauO治疗tau病理的关键知识差距和潜在策略。

1. 背景
慢性神经炎症、认知障碍和病理性tau蛋白在大脑中的沉积是衰老相关神经退行性tau蛋白病的常见特征,包括阿尔茨海默病(AD),迄今为止没有缓解疾病的治疗方法。在AD中,淀粉样β蛋白(Aβ)和tau蛋白聚集体的积累具有神经毒性,它们的积累增加会破坏神经元和神经胶质细胞的功能和通讯,导致突触和神经元损失。慢性炎症是其另一个标志,通常源于星形胶质细胞和小胶质细胞的功能障碍,星形胶质细胞和小胶质细胞是大脑中负责神经元稳态和废物清除的细胞。在AD中,星形胶质细胞和小胶质细胞努力支持神经元细胞并清除废物,包括导致神经元功能障碍和大脑持续炎症的Aβ和tau聚集体。此外,血管因素也在AD中发挥作用。脑动脉、动脉粥样硬化和小中风中Aβ和tau聚集物的沉积会减少流向大脑的血流量和氧气,并损害血脑屏障(BBB)的完整性,血脑屏障保护大脑免受有害因素的影响,同时选择性地允许必须物质的运输。因此,这些受损的血脑屏障和血管功能导致炎症加剧和脑萎缩。新出现的证据表明,AD相关的脑病理学是aβ和tau以及其他几个因素之间复杂的相互作用的结果。病理性tau蛋白似乎在与记忆密切相关的特定大脑区域积累,病理性tau蛋白按照与临床严重程度和痴呆相关的典型模式扩散到整个大脑。由于颞叶的早期神经变性,AD最初会影响短期记忆、学习和空间导航。然而,在终末期,病理扩散到其他大脑区域,并导致语言、运动技能和其他能力的各种损伤。AD也被归类为神经退行性tau蛋白病,其特征是微管相关蛋白tau积聚成称为神经原纤维缠结(NFT)的亚稳定tau聚集体。在AD患者中,痴呆的临床严重程度与病理性tau聚集体的负荷密切相关。此外,在没有淀粉样斑块的情况下,病理性tau蛋白聚集体可在许多原发性人类tau蛋白病中诱发神经毒性、慢性脑部炎症和随后的认知障碍,包括皮克病(PiD)、进行性核上性麻痹(PSP)和皮质基底节变性。尽管NFT是AD和其他人类tau蛋白病的病理标志,但含NFT的神经元可以存活数十年,这表明NFT既不是强制性的,也不足以诱发神经元功能障碍和毒性。在这种情况下,作者的实验室和其他人发现,较小的可溶性tau低聚物(TauO)—而不是NFTs—是毒性最大的tau物种。神经元可以在细胞外释放TauO,TauO作为“种子”,以朊病毒样方式促进tau病理的传播和繁殖,并诱导认知缺陷。TauO以多种方式与AD的aβ和其他病理特征相关联。Aβ可以通过激活炎症通路和削弱tau的清除来触发TauO的产生。TauO还可以通过促进淀粉样蛋白在神经元中的摄取和聚集来增强淀粉样蛋白的毒性,并且它还促进BBB损伤,促进更多的炎症因子进入大脑并恶化神经变性。TauO还与突触功能障碍有关,突触功能障碍是AD认知障碍的主要原因。此外,作者观察到临床严重AD患者的大脑、脑脊液(CSF)和血清中TauO水平升高,表明致病性TauO在AD和其他TauO病的病因中起着至关重要的作用。
衰老是AD的主要危险因素。每十个65岁或以上的人中就有一个患有AD,其患病率随着年龄的增长呈指数增长。AD仍然是65岁或以上人群的第五大死亡原因。阿尔茨海默氏症协会估计,美国的AD病例数量将从2023年的670万增加到2060年的1270万。这将给个人、家庭、医疗保健系统和社会带来巨大负担。目前对AD的治疗只能缓解部分症状,但无法阻止或逆转该疾病引起的潜在脑损伤。因此,迫切需要能够改变AD病程并预防或延缓其发作和进展的新疗法。最近对人类和动物模型的研究表明,衰老与衰老细胞的积累增加有关。各种内源性和外源性应激源(如病理性tau聚集体)可诱导不同类型脑细胞衰老。重要的是,选择性清除衰老细胞可延长老年动物的健康寿命,还可防止AD相关的脑部病理和认知能力下降,表明衰老细胞驱动衰老并在AD进展中起因果作用。衰老细胞的这些有害作用是由一种称为衰老相关分泌表型(SASP)的异常炎症分泌组介导的,这种分泌组与衰老相关的慢性炎症(即炎症)有关。因此,TauO与衰老和炎症一起成为重要的潜在治疗靶点。这些发现表明,TauO、衰老和炎症是AD的关键因素,并可能共同触发AD进展和认知衰退中涉及的潜在复杂病理机制。
在这篇综述中,作者提供了对TauO、衰老和炎症的病理机制及其随后对人类和动物模型中脑病理学和认知功能的影响的见解。作者总结了解释TauO、衰老和炎症参与TauO病进展和发作的机制联系。最后,作者讨论了针对衰老、炎症和TauO的潜在治疗策略,用于AD和相关痴呆的未来治疗。

2. 细胞衰老是AD病理的一个组成部分
人群研究表明,衰老是AD和神经退行性tau病进展和发展的最重要的危险因素。洛佩兹—奥廷等人详细回顾了衰老的九个特征:细胞衰老、线粒体功能障碍、端粒磨损、基因组不稳定、表观遗传改变、营养感知失调、蛋白沉积丧失、干细胞耗竭和改变细胞间通讯。这些衰老过程与多种神经退行性疾病(包括AD和TauO病变)的驱动密切相关。在这些衰老特征中,细胞衰老通过SASP在大脑衰老、神经变性和痴呆中起着至关重要的作用,SASP是炎症的主要来源。最近的研究精确地表明,使用遗传或药理学方法选择性去除衰老细胞可延长老年动物的健康寿命和寿命,可减少慢性炎症和大脑病理,并改善认知功能,这表明细胞衰老不仅会导致衰老,还会导致认知能力下降。除了几个遗传和环境因素,SASP或炎症可能会相互影响,增加AD的风险(图1)。
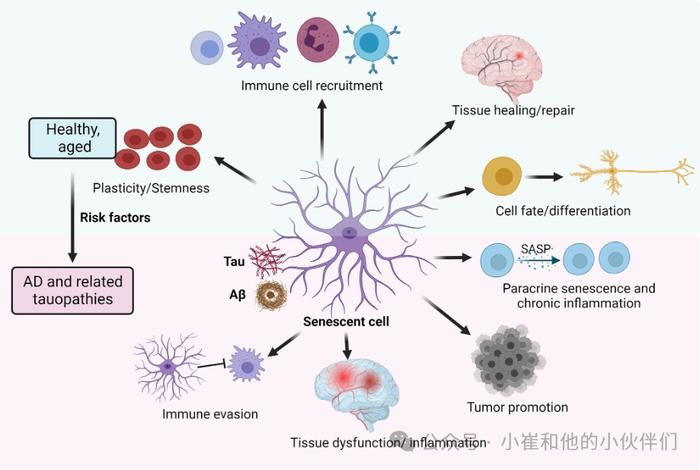
图1:细胞衰老是健康衰老和AD的一个组成部分
Hayflick在60多年前首次发现细胞衰老是一种细胞增殖停止的现象。衰老的概念被扩展到包括由致癌激活或暴露于细胞毒性试剂诱导的早衰。最近,细胞衰老被重新定义为一个多步骤和复杂的生物过程,涉及不可逆的细胞周期停滞、抗凋亡、蛋白质生成增加、代谢变化(如糖酵解增加、脂肪酸氧化减少)、活性氧(ROS)生成增加和SASP的获得。许多过程,包括DNA损伤、端粒磨损、致癌突变、氧化应激、慢性炎症/感染和蛋白毒性应激,都与衰老有关或导致衰老,所有这些也随着年龄的增长而增加。
衰老细胞表现出永久性细胞周期停滞、抗凋亡和DNA损伤反应(DDR),并伴有独特的分泌表型,产生炎症和基质降解蛋白,称为SASP。衰老细胞显示出增大的细胞形态和膨胀的溶酶体区室,这使得能够在6的次优pH下检测β-半乳糖苷酶活性,通常称为衰老相关β-半乳糖糖苷酶(SA-β-gal)活性。衰老可由多种因素引发,包括潜在的DDR诱导剂、癌基因激活和突变、氧化应激、代谢损伤、aβ和tau诱导的蛋白毒性应激,以及与损伤相关分子模式(DAMPs)和病原体相关分子模式相关的慢性炎症(图2)。衰老细胞通过上调与DDR(如γ H2AX)、抗凋亡(如BCL-XL/BCL-W)和细胞周期停滞(如p16INK4A和p21Cip1)相关的蛋白质来逃避凋亡。最近的研究确定了病理性tau和Aβ聚集体在触发AD衰老中的作用。TauO和Aβ聚集体以及其他刺激主要激活DDR信号,这是衰老的主要潜在原因。DDR触发几种蛋白激酶的激活,如磷酸化组蛋白H2AX(γ H2AX)、顶端激酶共济失调毛细血管扩张症突变(ATM)和共济失调毛细血管扩张症和Rad3相关蛋白(ATR)。这些信号级联启动DDR介质(如MDC1,53BP1)的募集,激活CHK1和CHK2检查点,并刺激p53-p21CIP1通路激活,最终导致不可逆的细胞周期停滞。
随着年龄的增长,包括大脑在内的全身不同组织中的衰老细胞负荷增加。衰老细胞会导致衰老相关的组织退化和功能障碍以及人类慢性疾病。衰老细胞的其他主要特征包括染色质重塑,这是由于细胞核层蛋白核纤层蛋白B1和高迁移率族蛋白1(HMGB1)的丢失,随后被释放到细胞外微环境中(图2)。结果,先天免疫反应的激活导致急性和慢性炎症反应。最近几篇备受瞩目的出版物强调靶向和清除tau和(或)aβ诱导的衰老细胞是预防与AD相关的神经变性的一种新的治疗方法。因此,在这篇综述中,作者检查了衰老、炎症和AD之间联系的证据。
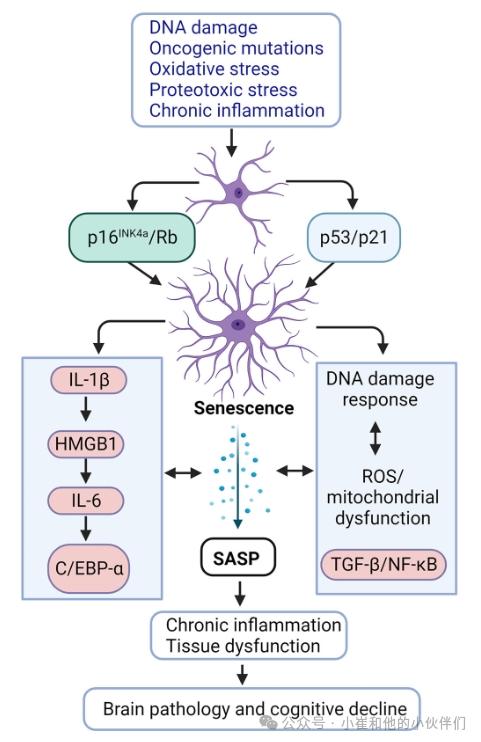
图2:几种诱导剂单独或组合可以通过p16INK4a/Rb和p53/p21途径触发衰老

3. SASP:衰老中慢性炎症的主要来源
虽然衰老细胞仅占总组织的4%至15%,但它们是衰老相关疾病进展的主要因素。衰老细胞具有高度代谢活性,因此产生大量SASP,这是在衰老过程中诱导慢性炎症的最重要病理因素之一。SASP通过诱导邻近细胞的凋亡或旁分泌衰老来破坏组织稳态,从而加速生物衰老过程。SASP的组成是异质性和动态的,它因细胞类型而异,然而,总的来说,SASP执行三个关键功能。首先,SASP通过正前馈机制加强细胞周期停滞和自身表型的永久化,这解释了衰老的肿瘤抑制活性。其次,SASP的许多成分通过称为旁分泌衰老的生化过程将衰老传递给邻近细胞。第三,SASP招募免疫细胞,从组织中清除衰老细胞并停止炎症。有趣的是,尽管衰老细胞的免疫监测在癌症和胚胎发育的背景下是有利的,对老年大脑中衰老细胞的免疫监测可能通过自然杀伤细胞介导的细胞毒性和受损的神经发生而导致认知能力下降。免疫细胞衰老会损害免疫系统功能,降低衰老细胞的清除率。从根本上说,SASP会通过副免疫细胞损害组织再生能力。SASP会进一步加剧慢性炎症,并增加老年人的死亡和发病风险。在人体血浆中检测到SASP因子水平升高,这与虚弱和不良的术后临床结果呈正相关。更重要的是,在老年人的血液和脑脊液中发现SASP水平升高,并与衰老小鼠神经发生减少。在年轻成年小鼠中模仿增加的SASP会损害神经发生、海马依赖性学习和记忆。这些观察结果表明,外周血中的SASP会对神经发生和认知功能产生负面影响。根据这一证据,最近一项使用异时血液交换的研究表明,老年小鼠的血液会诱导年轻小鼠的细胞和组织衰老,用抗衰老药物治疗会消除SASP的这些促衰老作用,这表明血液中的SASP因子会引发衰老的快速而强劲的扩散。此外,清除衰老小鼠中的衰老细胞会减弱循环中炎症介质的产生,强调衰老细胞是炎症的主要来源。相反,将少量衰老细胞移植到年轻小鼠体内会增加慢性炎症,导致持续的身体功能障碍,并缩短寿命。因此,SASP是驱动生物衰老过程和慢性衰老相关疾病发作的重要因素,包括神经系统疾病退化的SASP成分已被证明由TauO和Aβ诱导,并以各种方式导致AD模型或患者的认知障碍。白细胞介素-1β(IL-1β)是一种促炎细胞因子,是SASP的一部分,可由大脑中的aβ和TauO诱导。IL-1β可激活小胶质细胞和星形胶质细胞,进一步产生炎症介质,加重脑部炎症。IL-1β通过影响对学习和记忆很重要的N-甲基-D-天冬氨酸(NMDA)受体的表达和功能来损害突触可塑性和记忆形成。最近的研究表明,IL-1β的产生受NLRP3炎症体的调节,NLRP3炎症体是一种由NLRP3、ASC和胱天蛋白酶1组成的多蛋白复合物。NLRP3炎症小体的激活驱动tau病理。敲除ASC或NLRP3可改善动物模型中的AD样脑病理。肿瘤坏死因子α(TNF-α)是另一种促炎细胞因子,是SASP的一部分,可由大脑中的Aβ和TauO诱导。TNF-α还可以激活小胶质细胞和星形胶质细胞,诱导ROS的产生,从而损害神经元和突触。TNF-α还能促进tau蛋白的磷酸化和聚集,形成神经毒性低聚物和原纤维。TNF-α通过影响AMPA受体的表达和功能来损害突触传递和可塑性,AMPA受体对突触强度和可塑性很重要。转化生长因子β(TGF-β)是Aβ和TauO诱导的SASP的另一个重要成分,它还可以通过激活非Smad信号通路来增强神经炎症、tau病理和神经变性,这可以诱导氧化应激、凋亡和自噬损伤。
大多数SASP蛋白在不同细胞类型中进化保守,但不同的细胞类型和组织分泌不同的SASP成分。需要进一步研究以确定不同的神经胶质细胞是否在AD发病和进展中产生独特的SASP成分。非蛋白SASP因子的贡献,如缓激肽、活性氧或核苷酸仍未得到很好的研究。值得注意的是,SASP的组成可能在衰老诱导后随时间变化,并取决于刺激或启动机制,如在RAS、p16INK4a和p53诱导的衰老中观察到的。因此,SASP是动态和异质性的,其组成、数量和程度取决于特定的细胞类型和诱导剂。在脑细胞(包括神经元、星形胶质细胞、小胶质细胞、少突胶质细胞和内皮细胞)的背景下,已经在动物模型和人类AD患者的大脑中观察到与Aβ或tau相关的衰老表型,这表明SASP的组成和动力学可能有助于疾病的异质性和认知能力下降的速度。

4. HMGB1:一种炎症性SASP成分和旁分泌衰老介质
在本节中,作者将讨论HMGB1在衰老、炎症和AD发病机制中的作用。HMGB1是一种高度保守的非组蛋白DNA结合蛋白,属于HMG蛋白家族。在哺乳动物细胞核中,HMGB1是最丰富的非组蛋白,每10个核小体中有一个HMGB1分子。尽管其在细胞核中的丰度和保守性很高,但HMGB1已被广泛研究为细胞外炎症因子和DAMP,因此被称为“警报素”,当出现感染、损伤或Aβ或tau病理时,HMGB1由活化的免疫细胞主动分泌,或由坏死和受损的细胞被动释放,作为警报素。细胞外HMGB1与toll样受体4(TLR4)和晚期糖基化终产物受体(RAGE)受体相互作用,引发慢性炎症。这种细胞外HMGB1会导致慢性炎症,这可能会减缓或停止组织再生和稳态,最终导致组织退化。在衰老细胞的背景下,HMGB1经历从细胞核到胞质溶胶的易位,在那里它被释放到细胞外空间,通过RAGE和TLR4信号通路触发炎症。HMGB1是人类和小鼠组织衰老表型的早期和中枢介质,研究表明,HMGB1的重新定位和分泌调节SASP,从而在体外和体内促进旁分泌衰老。在增殖细胞中,HMGB1在DNA修复、V(D)J重组和染色质装配中起着至关重要的作用。HMGB1缺陷细胞的核小体较少,使染色质更容易受到DNA损伤、转录失调和炎症反应的影响。该蛋白质结合染色质,弯曲和扭曲DNA,并促进转录因子(如p53)的结合。p53和pRB对SASP都不是必需的,事实上p53缺陷会进一步放大SASP。p53的上游信号分子(如H2AX、CHK2、NBS1、ATM)在SASP中起着不可或缺的作用,也作为DDR蛋白发挥作用。最近的研究表明,HMGB1协调SASP相关的染色质折叠和RNA体内平衡,从而调节自分泌和旁分泌衰老。细胞核中HMGB1的缺失及其随后的分泌是哺乳动物细胞衰老的标志。相比之下,持续增殖的癌细胞在细胞核中表现出比正常组织中更高水平的HMGB1,这表明细胞核HMGB1的丢失是衰老途径进展中的关键事件。HMGB1结合并调节一组与衰老调节有关的独特mRNA转录物。已知培养中的衰老细胞也会主动释放HMGB1,HMGB1的缺失或敲除会诱导衰老。此外,HMGB1的定量分析显示,老年小鼠中该蛋白的血清水平高于年轻小鼠,表明细胞核HMGB1的耗竭及其主动释放是小鼠和人类衰老细胞的重要保守特征。
此外,作者和其他人证明了细胞外HMGB1促进邻近细胞的旁分泌衰老,并通过SASP诱导慢性组织炎症,表明衰老可以通过SASP/HMGB1轴传递。斯查费等人调查了血液中的SASP成分与人类衰老相关功能障碍之间的相关性。他们报告了SASP成分与年龄、虚弱和术后健康缺陷之间的正相关,表明SASP的循环水平与晚期衰老和有害健康结果有关。这些发现表明,SASP可以作为晚期年龄相关疾病的临床生物标志物和治疗靶点。重要的是,实验证据表明,细胞核HMGB1的存在是生存所必需的,因为HMGB1敲除的小鼠在出生后不久就会因严重低血糖而死亡。细胞核HMGB1的缺失也与小鼠和人类的器官衰竭有关。作者报道了在AD患者的死后脑组织中,HMGB1从细胞核转移到细胞质是衰老和脑炎症的分子标志。
HMGB1被认为通过促进脑部炎症、Aβ和tau病理、神经突起变性和认知障碍而参与AD的发病和进展。HMGB1主要通过小胶质细胞和星形胶质细胞触发旁分泌衰老和炎症。这种慢性炎症促进tau磷酸化和聚集,并增加其在细胞质中的积累,导致突触和神经元功能障碍和死亡。值得一提的是,在AD患者和老年啮齿动物的大脑和脑脊液中发现HMGB1水平升高,并与疾病严重程度相关。重要的是,暴露于aβ和TauO等病理蛋白聚集体会引发HMGB1释放、慢性炎症以及RAGE和TLR4信号通路的上调。使用5XFAD转基因小鼠模型,研究人员证明细胞外HMGB1通过TLR4-MARCKS通路在AD早期启动神经突起变性。此外,用抗HMGB1抗体或HMGB1释放抑制剂治疗可减少AD相关的神经病理学,减少大脑中衰老细胞的负担,缓解神经炎症,并改善AD小鼠模型中的认知功能。值得注意的是,显著的神经元坏死发生在症状前AD的早期阶段;因此,HMGB1水平在临床诊断的症状前AD中显著升高,但在有症状的晚期AD中不升高。神经元坏死后,病理性aβ和TauO被释放到细胞外空间,并以朊病毒样方式成为AD神经病理学传播的种子。此外,来自AD模型的证据表明,用抗体、抑制剂或拮抗剂靶向HMGB1、RAGE或TLR4可以减少神经炎症、aβ和tau病理学,并改善认知功能。总之,这些发现强调了HMGB1通过触发旁分泌衰老、炎症、tau病理学和临床严重程度对AD发病机制的重要作用。因此,靶向HMGB1联合TauO有望成为AD的治疗策略。作者的实验室最近表明,使用丙酮酸乙酯和甘草酸抑制HMGB1的释放可缓解tau低聚物诱导的衰老,如tau病小鼠模型中的表型、神经炎症和认知下降。需要进一步的研究工作来发现能够有效靶向HMGB1或其内源性调节因子的新分子。

5. 炎症:加速衰老的关键因素
炎症是指血液和组织中与衰老相关的炎症标记物水平升高,导致慢性低度炎症。它是几种疾病的重要病理因素,包括在老年人中高度流行的AD和TauO病变,导致残疾和加速衰老。炎症是人类加速衰老的生物标志物,可通过旁分泌机制加剧与年龄相关的自然组织退化。炎症可通过损害Aβ肽的清除、改变血脑屏障的完整性和影响突触功能来驱动AD的tau病理学和神经退行性变。炎症细胞因子(如IL-6、TNF-α和IL-1β)的水平随着免疫系统失调而增加(即疫苗效率丧失、感染/损伤发病率增加、癌症和自身免疫性疾病发病率增加)。研究表明,循环炎症分子水平与神经退行性疾病的进展呈正相关。
炎症可以通过几种机制驱动AD中的tau病理和神经变性。一种机制是炎症损害A β和tau聚集体的清除,这可以触发小胶质细胞和星形胶质细胞的激活,并诱导促炎细胞因子和ROS的产生。这些炎症介质会损害神经元和突触,还会促进tau磷酸化和聚集,最终损害轴突运输、突触功能和神经元活力。另一种机制是炎症会损害血脑屏障的完整性,从而增加外周炎症因子(如细胞因子、趋化因子和免疫细胞)进入大脑。这些因素可进一步加重AD的脑部炎症,加剧tau病理和神经变性。第三种机制是炎症影响突触前和突触后tau水平之间的平衡,并损害tau与其他突触蛋白的相互作用,如Fyn激酶、PSD-95和NMDA受体。这些改变会损害突触传递和可塑性,并导致记忆障碍。
SASP成分,包括C-反应蛋白和IL-1家族细胞因子,已被提议作为AD疾病进展的标志。在衰老的大脑中,神经毒性错误折叠蛋白聚集体,如Aβ和tau,被小胶质细胞(大脑的常驻巨噬细胞)和星形胶质细胞(神经元支持细胞)通过高度保守的模式识别受体(如TLR4)识别。这加剧了神经元毒性、蛋白质聚集、突触功能障碍和慢性脑部炎症,产生了放大和维持脑部炎症的前馈回路。这种有害的循环进一步导致大脑的结构和功能退化,加剧了神经变性的进展。AD病理学和炎症的年表被描述为一个波浪模型,具有加速神经变性的多个相互关联的细胞和分子过程(图3)。
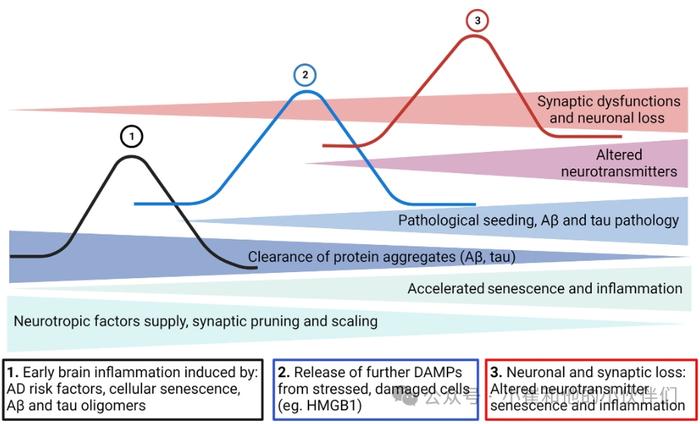
图3:显示AD病理事件年表的三波模型
Aβ和tau存在于不同的聚集阶段,包括单体、寡聚、原纤维和斑块/缠结,每种聚集阶段对胶质细胞活化和慢性脑炎症都有不同的影响。这些病理性蛋白聚集体的清除受损导致AD病理的播种和繁殖。神经胶质激活触发炎性细胞因子的释放,如IL-1β、TNFα和IL-6,可在AD患者的脑和CSF中发现。这些炎症介质的过表达激活神经元信号级联,触发蛋白激酶如细胞周期蛋白依赖性激酶5的激活,以及磷酸酶如PP1的失活。这导致tau磷酸化和神经毒性低聚物和原纤维的形成,进一步放大神经胶质激活和大脑炎症。神经毒性炎症介质的过度释放对神经递质水平产生负面影响,导致神经元功能障碍和死亡(图4),表明Aβ和tau病理以及炎症共同导致AD进展。因此,调节炎症/SASP可能是AD和tau蛋白病的一种有前途的治疗方法。
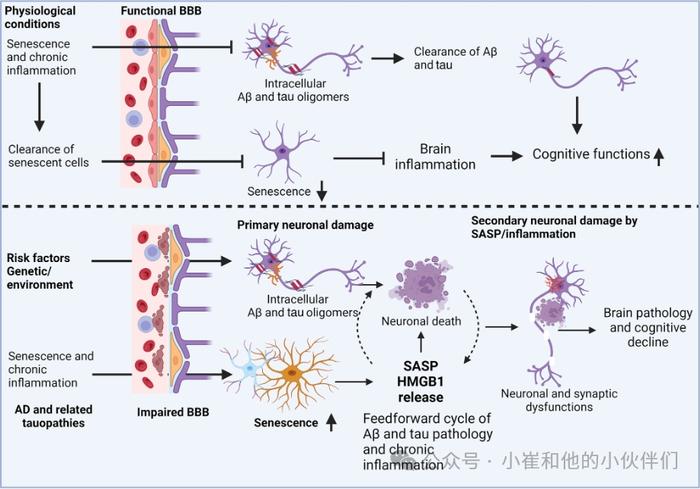
图4:AD发病机制示意图

6.TAU蛋白诱导的脑部炎症、衰老和炎症在AD中的作用
临床AD症状和痴呆通常在长期的临床前或前驱AD阶段后表现出来,这表明识别和靶向早期致病事件可以阻止或延缓AD的进展。临床证据表明,TauO和脑部炎症也出现在临床前或前驱AD阶段,比痴呆发作早几十年。这种早期脑部炎症可能会因TauO和大脑中的衰老细胞而加剧或驱动,通常与认知能力下降有关。支持这一观点的一项研究报告称,脑部炎症会导致早期记忆丧失,增加脑部炎症,并增加大脑中衰老细胞的负荷。它建立了另外两个关键病理特征aβ和tau聚集体之间的联系。越来越多的证据表明,炎症与tau病理有着复杂的关系,tau病理会导致AD病理和认知能力下降。重要的是,使用布洛芬(一种非甾体抗炎药)进行治疗,可显著减少脑部炎症、衰老细胞负荷并改善认知功能。这些观察结果表明,衰老诱导的慢性脑部炎症是衰老相关认知衰退的一个重要病理因素。脑部炎症还可以通过上调干扰素诱导的跨膜蛋白3(IFITM3)引发病理性淀粉样蛋白的沉积。值得注意的是,IFITM3通过衰老大脑中衰老细胞释放的小细胞外载体介导旁分泌衰老,进一步支持了淀粉样蛋白沉积、慢性炎症和脑衰老中衰老之间的相互作用。这些发现支持了抑制脑部炎症可以阻止或延缓轻度认知障碍(MCI)发展为痴呆的观点。衰老和SASP与轻度认知障碍和阿尔茨海默病的关系进一步得到了实验证据的加强,实验证据表明,衰老疗法通过减少脑部炎症,在加速衰老、tau病、AD模型鼠方面提供了有益的效果。衰老疗法调节AD进展的能力也正在试点临床试验中进行评估。除了衰老,脑部炎症的其他重要来源也与AD风险因素有关。例如,创伤性脑损伤(TBI)通过免疫系统的急性和慢性改变以及对感染的易感性增加来诱导脑部炎症。重要的是,TBI还会引发病理性TauO的形成和神经胶质细胞衰老生物标志物的上调,从而在TBI、TauO和细胞衰老之间建立联系。然而,需要进一步的研究来了解TBI诱导的衰老和炎症的潜在机制及其在AD发病机制中的作用。
此外,由于衰老相关的血管损伤,许多来自外周的因素到达大脑,这是慢性大脑炎症的另一个重要来源和刺激因素。例如,大脑小血管疾病会增加AD患者认知能力下降和痴呆的风险。慢性炎症诱导的血脑屏障破坏是人类认知功能障碍的早期生物标志物,通常会导致痴呆,aβ沉积和tau病理都会加重血管损伤。周细胞在脑血流调节和支持血脑屏障功能中发挥作用,对于维持大脑稳态非常重要,已知它们的丢失会影响AD相关的神经变性。有人认为,Aβ和tau的积累与周细胞功能障碍有因果关系,周细胞功能障碍会导致AD早期脑血流量减少。有趣的是,周细胞主要通过趋化因子配体与神经元沟通此外,最近的证据表明,肥胖和高胰岛素血症也可引发衰老和慢性炎症,损害大脑稳态。
全基因组关联研究表明,炎症相关基因的各种多态性变异体是AD的风险因素,表明炎症在AD中起着重要作用。与AD风险相关的两个重要基因是APOE和TREM2。使用AD小鼠模型以及人类AD脑组织死后分析的研究表明,TREM2-APOE途径的激活会触发小胶质细胞从稳态表型向疾病相关小胶质细胞(DAM)表型的转变,其特征是炎症反应增加。有趣的是,衰老和SASP会促进DAM表型的出现,并导致AD病理。这些研究共同强调,脑细胞在暴露于TauO和aβ以及全身炎症因子时会发生衰老,从而引发进一步的脑病理学、炎症反应和认知能力下降。

7. AD脑中不同细胞类型衰老的证据
根据目前的文献,AD大脑中经历衰老的细胞类型的证据仍然很少。在这一节中,作者简要讨论了AD背景下不同类型脑细胞的衰老。
7.1小胶质细胞
小胶质细胞是大脑的第一反应者和先天免疫细胞。它们参与大脑的监视,并通过吞噬作用主动清除细胞碎片和致病分子,从而在大脑稳态中发挥关键作用。大量研究报道了小胶质细胞与衰老相关的变化。衰老的小胶质细胞与AD中病理性tau蛋白的扩散和神经变性有关。与年龄匹配的非痴呆对照个体的大脑相比,AD、路易体痴呆(DLB)和边缘优势年龄相关的TDP-43脑病患者的大脑中衰老的小胶质细胞数量更高。在病理条件下,小胶质细胞表现出典型的衰老特征,如氧化应激增加和核染色质改变。在aβ和tau蛋白病理发作期间,小胶质细胞表现出快速增殖反应,并促进疾病进展。有趣的是,最初经历快速增殖的小胶质细胞后来可能转变为DAM表型,其特征是有害的炎症反应。DAM也表现出SEN的典型特征如SA-β-gal活性增加、端粒缩短和转录信号。这些研究表明,在大脑中有智慧的人小胶质细胞的一个亚群可以表现出导致炎症和神经变性的衰老表型。
7.2星形胶质细胞
星形胶质细胞是大脑中非常丰富的神经胶质细胞,为神经元提供代谢、结构和功能支持。它们参与调节神经元营养支持,离子稳态,大脑炎症和认知功能。星形胶质细胞还控制氧化应激、生长因子的释放,并有助于血脑屏障完整性的建立和维持。星形胶质细胞端足形成血管周围网络和淋巴系统的重要组成部分,促进间质液和CSF的交换。由于星形胶质细胞靠近神经元,通过三方突触促进多个神经元之间的神经传递,并参与神经递质再循环。集体证据强调了星形胶质细胞在支持神经元功能中的重要作用。
AD中的星形胶质细胞经历衰老,在AD病理学和认知衰退的发展和进展中起着至关重要的作用。衰老的星形胶质细胞失去其神经保护功能并获得神经毒性功能,导致神经元功能障碍和神经病理学。星形胶质细胞衰老通过获得SASP或丧失代谢物转移能力对神经元产生负面影响,代谢物转移能力对神经元支持至关重要。星形胶质细胞衰老通过获得炎症性SASP诱导神经毒性作用,并导致神经退行性疾病(包括AD、PSP和PiD)的病因。衰老星形胶质细胞的特征是胶质纤维酸性蛋白和波形蛋白水平升高,SA-β-gal活性、p16INK4a表达、SASP上调,以及核层粘连蛋白B1和HMGB1缺失。使用5XFAD小鼠模型的单核RNA测序研究显示,衰老星形胶质细胞是炎症性疾病相关的星形胶质细胞,并显示出衰老和炎症表型的特征,这出现在AD病理的早期阶段,其丰度随着疾病的进展而增加。本研究还表明衰老的人脑中存在衰老的星形胶质细胞,表明炎症性疾病相关的星形胶质细胞、衰老和AD病理学之间存在联系。此外,在暴露于氧化应激和X射线照射时,原代人星形胶质细胞在体外经历衰老,并表现出衰老生物标志物如chassa β-gal活性和p16INK4A和p21水平升高。星形胶质细胞的这种衰老诱导下调谷氨酸盐和钾转运蛋白,从而导致兴奋性毒性和神经元细胞死亡。对死后脑组织的分析证实,人类AD大脑中衰老星形胶质细胞的负荷加剧。
布西安等人发现在tau蛋白病动物的大脑中,衰老的星形胶质细胞(16%)的负担高于衰老的小胶质细胞(4%)。该研究表明,选择性清除这些衰老的胶质细胞可减缓tau蛋白病和认知障碍的进展,这表明衰老的星形胶质细胞在tau蛋白病进展和认知衰退中起着关键作用。然而,小胶质细胞作为第一反应者可能首先经历衰老,然后通过旁分泌机制诱导星形胶质细胞衰老。作者最近的研究表明,星形胶质细胞从细胞外环境内化病理性TauO。TauO诱导原代星形胶质细胞衰老表型,并通过分泌IL-1β、IL-6和TNF-α引发慢性炎症反应。同样值得注意的是,TauO相关的星形胶质细胞在人类AD和额颞叶痴呆大脑中表现出衰老表型。衰老细胞的积累与神经血管功能障碍有关,表现为认知能力下降。这些结果表明,大脑中TauO和衰老星形胶质细胞的积累,以及SASP的有害后果,有助于AD病理和认知能力下降的进展。因此,针对TauO、衰老星形胶质细胞和/或SASP的联合方法可以有效地延缓AD的进展和认知能力下降。
7.3少突胶质细胞
少突胶质细胞是大脑中第三种主要类型的神经胶质细胞,起源于少突胶质祖细胞(OPC)。在脑损伤/病理情况下,OPC迁移到脑损伤部位并分化为少突胶质细胞,以促进受损轴突的髓鞘再生。然而,随着年龄的增长,OPC的增殖受到损害,导致少突胶质细胞的髓鞘再生能力丧失,从而导致疾病进展。在这种情况下,最近的一项研究表明,aβ在AD患者大脑以及APP/PS1转基因AD小鼠模型的OPC中引发衰老表型。这些观察结果与早期的报告一致,表明病理条件可以促进OPC衰老。需要进一步的研究来确定OPC衰老是否是对aβ的特异性反应,或者是否其他病理蛋白如tau、α-突触核蛋白和TDP-43也可以诱导OPC衰老。一般来说,与小胶质细胞和星形胶质细胞相比,OPCs和少突胶质细胞在AD发病机制中的作用还没有得到很好的研究。因此,研究OPCs和少突胶质细胞对AD病理的反应将极大地增强作者对AD发病机制的理解。张等人的研究证明使用FDA批准的小分子达沙替尼和槲皮素(D+Q)的衰老治疗可防止Aβ积聚和OPC衰老,从而改善学习和记忆并减少炎症。值得注意的是,这项研究还揭示了D+Q可以在衰老出现之前预防β斑块的形成,这表明D+Q具有非靶向作用。值得注意的是,槲皮素已被证明可防止HMGB1的释放并减少炎症,从而改善各种AD模型中的认知功能。未来的研究需要确定D+Q在AD模型和临床试验中的衰老和非衰老作用。总之,这些研究表明,D+Q治疗可能是通过减少Aβ积聚、OPC衰老和HMGB1介导的炎症和旁分泌衰老来预防或延缓AD发病的有效策略。
7.4神经元
神经元是大脑中负责传递和处理信息的基本细胞。当暴露于毒性Aβ和TauO时,大多数神经元死亡;然而,一些神经元异常地重新进入细胞周期,这保护它们免于细胞死亡。这增加了一种可能性,即在病理条件下,神经元可能会衰老。在这方面,据报道,衰老神经元的患病率随着年龄的增长而增加,这表明神经元衰老在大脑衰老和神经退行性疾病中的潜在作用。有趣的是,衰老细胞对凋亡具有抗性,这表明衰老可以促进神经元死亡的其他机制,如坏死性凋亡,这与AD大脑中的神经元损失有关。尽管神经元被认为是终末分化细胞,但它们是否会衰老仍是一个有争议的问题。研究显示了相互矛盾的结果;布塞恩等人。证明神经元在tau病小鼠模型中不表现出衰老表型。另一方面,Musi等人。在另一个tau病小鼠模型中显示tau积累与神经元衰老有关。有利于神经元衰老而非凋亡的进化机制可能有利于保存大脑中的细胞数量。然而,这可能以有限的再生潜力和有害的SASP因子的促进为代价。需要进一步的研究来阐明神经元衰老的作用及其对AD的贡献。了解衰老、凋亡和其他形式的神经元细胞死亡之间的相互作用将为神经变性的潜在机制提供有价值的见解,并可能指导新治疗策略的开发。
7.5内皮细胞
血管功能障碍,尤其是内皮功能障碍,在AD的发病和进展中起着重要作用。研究表明,脑微血管内皮细胞的衰老诱导导致内皮功能障碍和血脑屏障破坏,从而促进认知障碍。Bryant等人的一项研究。证明与年龄匹配的对照组患者相比,AD患者的B3微血管具有显著升高的衰老标记物和粘附蛋白水平,这些标记物和粘附蛋白与tau病理特别相关。脑小血管疾病显著增加了AD患者认知能力下降和痴呆发作的风险。周细胞在调节脑血流量和支持血脑屏障完整性方面起着至关重要的作用。周细胞的耗竭与AD相关的神经变性进展有关。有人提出,aβ和tau的积累与周细胞功能障碍相互关联,这导致了AD早期脑血流量的下降。有趣的是,周细胞主要通过趋化因子配体2与神经元沟通,趋化因子配体2是协调旁分泌的SASP中的关键角色。此外,新的研究强调,肥胖和高胰岛素等疾病emia还可以诱导衰老和慢性炎症,从而损害大脑的平衡和体内平衡。这一发现表明,病理性tau诱导的内皮细胞衰老可能与AD发病机制有关。因此,需要详细的研究来确定内皮衰老在AD中的作用。

8.病理TAU菌株在疾病异质性、临床症状多样性、神经病理学和认知衰退率中的意义
虽然tau蛋白沉积是神经退行性tau蛋白病的常见病理标志,但病例表现出临床和神经病理学异质性,导致不同的认知衰退率。先进的神经成像方法甚至可以在30至49岁的年轻人中检测tau蛋白和淀粉样β(aβ)沉积。在过去十年中,许多研究探索了tau蛋白和其他淀粉样形成蛋白以朊病毒样方式导致AD的概念。由独特蛋白质构象的繁殖介导的神经退行性疾病的突破性发现,如朊病毒疾病,被授予1997年诺贝尔生理学或医学奖。在AD中,病理性tau由神经元在间质液中释放,以典型的解剖模式传播和扩散tau病理。来自动物和细胞模型的大量证据令人信服地支持tau的朊病毒样特性,充当在整个大脑中传播tau病理的种子。tau病理在大脑中的传播与临床症状的异质性和严重性正相关。因此,tau聚集体可以形成不同的朊病毒样菌株或构象,影响神经退行性tau病的疾病表型、症状和神经病理学。最近备受瞩目的研究表明,尽管tau病进展的解剖模式相对一致,但AD患者在临床症状、神经病理学和认知衰退率方面表现出显著的异质性。重要的是,患者之间的异质性可归因于不同的种子活性tau o确认(即tau o菌株)。在AD患者中,tau聚集体在大脑中的沉积与神经元损失、认知能力下降和痴呆密切相关。值得注意的是,tau蛋白聚集本身就可能导致认知能力下降。病理性tau蛋白沉积在各种tau蛋白疾病中显示出不同的细胞和大脑区域特异性和分布模式。生化和形态学差异表明,病理性tau采用类似于朊病毒株的疾病特异性结构构象。冷冻电子显微镜的最新进展揭示了从不同tau蛋白病患者大脑中分离的病理性tau蛋白丝的原子结构。每种神经退行性tau病的特征都是在患有相同疾病的患者中高度保守的独特tau丝构象。体外聚集研究也证明了不同tau菌株从大脑中的种子繁殖。此外,在小鼠脑中注射这些tau菌株再现了在人类tau病的特定细胞类型和脑区中发现的独特tau病理学。tau亚型的组成、翻译后修饰以及与辅因子的相互作用可能会影响tau菌株在脑中的形成,最终导致临床表型的多样性和认知能力下降的速度。作者推测tau菌株在大脑中以细胞类型和区域特异性的方式差异传播,影响在tau病患者中观察到的临床和病理异质性(图5)。了解tau菌株的形成及其对神经元和神经胶质细胞的影响,对于破译人类tau蛋白病临床和病理多样性背后的分子机制至关重要。值得注意的是,其他神经病理学淀粉样蛋白如Aβ和α-突触核蛋白也表现出接种活性。此外,Aβ、tau和α-突触核蛋白相互作用,导致大脑中的共病理和加速的神经病理负担。在表达Aβ的小鼠中,接种人类野生型tau蛋白会下调参与突触调节和行为异常的基因,这表明Aβ和tau共同促进突触和认知障碍的进展。Narasimhan等人的一项研究。证明了从人类tau病脑中分离的不同tau菌株与不同的tau神经病理学相关。这项研究表明,特定TauO菌株(具有高接种活性)的tau接种活性增加,而其他菌株的tau接种活性增加,与AD患者更差的临床结果相关,这表明在患有典型AD的不同个体中存在TauO菌株。这些发现强调了AD与癌症一样,涉及常见疾病表型的多种分子驱动因素的可能性。他们还强调了针对特定tau菌株的个性化治疗方法的潜力,并阻止了AD的临床进展。
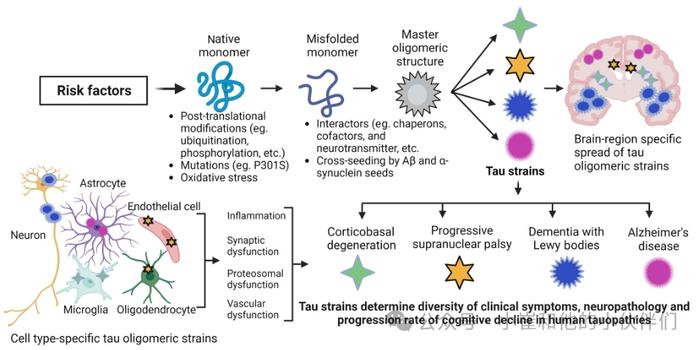
图5:示意图显示TauO菌株形成的潜在机制及其在疾病异质性、临床症状多样性、神经病理学和人类TauO病认知下降进展率中的意义
与tau蛋白一样,α-突触核蛋白和aβ寡聚物也表现出影响疾病表型的不同菌株。有趣的是,在局部和全身注射后,α-突触核蛋白菌株也可以诱导不同的突触核蛋白病,具有不同水平的毒性和行为表型。此外,tau蛋白和α-突触核蛋白等易聚集蛋白之间的交叉接种活性可导致不同淀粉样蛋白菌株的形成。鉴于α-突触核蛋白和tau聚集体在帕金森病和AD中共存,它们促进彼此交叉播种似乎是合理的。为了支持这一观点,作者之前的研究表明,α-突触核蛋白低聚物诱导了一种独特的毒性TauO菌株,该菌株逃避了原纤维的形成。将α-突触核蛋白/TauO注射到TauO病小鼠模型的大脑中会加速内源性TauO的形成和并发的神经变性,从而促进疾病的进展。为了支持这一观点,在人类神经退行性疾病中经常观察到不同疾病相关蛋白聚集体的共存。例如,超过50%的AD患者表现出路易体,而aβ斑块和NFT通常在帕金森病和DLB脑中检测到。对161名临床正常个体的死后大脑分析显示,86%表现出至少一种病理,63%表现出混合病理。此外,一项涉及4677名个体的荟萃分析报告称,三分之一的中度至高度AD神经病理学患者在其一生中没有发展为痴呆。组织学研究表明,高度AD神经病理学和正常认知的个体表现出对突触降解的抗性。在作者最近的研究中,作者证明了患有中度至高度AD神经病理学的认知正常个体的突触功能完整性与突触TauO的缺乏有关。该研究进一步支持了TauO在AD患者的突触功能障碍和认知障碍中的关键作用。TauO与α-突触核蛋白、Aβ和TDP43的相互作用导致合并症和混合神经病理学,通常导致AD患者的疾病异质性和临床症状进展率的差异。这些共病理如何导致疾病进展和临床异质性的潜在机制仍然是有待进一步研究的未决问题。关于Aβ、tau和α-突触核蛋白之间的分子相互作用及其对神经变性的影响的详细讨论可在作者最近的综述中找到。在这种情况下,一种形式的蛋白质聚集体可能直接交叉播种其他淀粉样蛋白,导致产生具有共同结构特征但不同播种活性和毒性的不同菌株。在AD大脑中可能存在病理性tau和α-突触核蛋白的不同菌株,导致观察到的显著疾病异质性。这表明在不同的蛋白病中存在多种显性寡聚菌株,支持具有各种表现和亚型的疾病进展。在这种情况下,特异性识别疾病相关tau菌株和构象的新型抗tau抗体的开发取得了重大进展。这些抗体针对独特的构象表位,独立于特定的线性氨基酸序列,并表现出对tau寡聚体不同亚群的偏好。此外,最近的研究引入了一种称为EMBER(激发多重明亮发射记录)的快速菌株鉴定方法。EMBER利用淀粉样蛋白结合染料的荧光激发/发射光谱,并采用机器学习技术在体外和转基因小鼠模型中识别不同的构象菌株。值得注意的是,EMBER能够快速识别来自各种神经退行性疾病(包括散发性和家族性AD、唐氏综合征以及PiD)的人脑切片中Aβ和tau沉积的构象差异。这些显著的发现极大地促进了作者对蛋白质错误折叠疾病的理解,并对该领域诊断和个性化治疗方法的未来发展具有重要意义。此外,假设TauO菌株可能以细胞类型和脑区特异性的方式不同程度地诱导衰老和SASP,进一步导致临床异质性和疾病进展的可变速率。因此,在AD和相关痴呆中观察到的临床疾病异质性的背景下,未来对tau菌株的深入研究是必要和有保证的。

9. 针对衰老、SASP和TAUO菌株的干预措施
尽管AD的患病率很高,但目前还没有治愈这种毁灭性疾病的方法。AD涉及不同脑细胞类型之间的复杂相互作用以及来自外周的因素,这些因素引发多方面的病理机制,包括细胞衰老、慢性炎症、线粒体功能障碍、蛋白质稳态受损以及细胞核和血脑屏障完整性受损,所有这些都与疾病进展有关。开发针对单一机制的疗法似乎并不可行和有效。旨在降低Aβ负荷的治疗大多结果令人失望,尽管最近FDA批准的抗Aβ抗体如lecanemab和aducanumab带来了一些希望。来自临床和临床前研究的新证据表明,衰老、慢性脑部炎症和TauO在AD中起关键作用,在临床症状出现前几十年出现并推动疾病进展。事实上,在AD的进展中,衰老细胞的积累、炎症和聚集的tau蛋白的积累之间存在相关性。这突出表明,针对这些因素中的一个或组合可能是开发治疗干预的有效方法。几项研究表明,tau聚集体可以引发细胞衰老和炎症,使用senolytics消除衰老细胞可以减少tau聚集体和炎症,并提高体内认知能力。人类研究还表明,衰老标记物与大脑中的炎症和tau病理学有关。几项研究表明,与年龄匹配的健康个体相比,负责调节细胞周期和衰老的基因CDKN2A(p16INK4a)在AD个体的大脑中高度升高。还发现p16INK4a的这种增加与炎症、tau缠结的密度和Braak分期相关,Braak分期是tau病理进展的一种度量。与对照组相比,已经发现由衰老细胞分泌并具有促炎作用的SASP成分在AD患者的CSF中升高。AD患者SASP成分的升高与CSF tau水平、炎症和认知障碍相关。在本节中,作者将简要讨论AD的治疗策略,重点关注衰老、SASP和TauO。
9.1衰老疗法:针对衰老的战略
AD和其他衰老相关疾病的一种有前途的治疗方法涉及使用衰老药物,其通过调节抗凋亡途径(如BCL-2-BCL-xL、PI3K/AKT、MDM2-p53-p21 cip 1-serpine元件)选择性地消除衰老细胞。衰老疗法在各种动物模型中显示出有希望的结果,包括tauopathies。目前,约有20项衰老疗法的临床试验正在进行中,其中两项(NCT04785300和NCT04685590)正在评估D+Q对轻度认知障碍或AD患者的治疗效果。一项I期临床试验表明,使用D+Q的组合可以消除糖尿病肾病患者的衰老细胞。但是,使用衰老疗法消除衰老细胞也可能有不良副作用。
或者,衰老形态化合物提供了一种不同的方法,通过抑制SASP而不杀死衰老细胞来减轻衰老相关的病理。异形干扰SASP表达途径(如p38MAPK、JAK/STAT、mTOR)和转录因子(如NF-κ β,STAT3)。用抗体或小分子中和特定的SASP因子是缓解衰老、SASP介导的慢性炎症和随后的组织损伤扩散的另一种策略。几项临床前研究已经证实了老年化治疗对年龄相关疾病的有益作用。然而,衰老治疗可能需要持续给药,并且由于SASP阻断,可能会破坏组织稳态。迄今为止,在临床和临床前研究中评估的几种衰老药物(如RAD001、ruxolitinib、KU-60019、洛哌丁胺、辛伐他汀、anakinra、canakinumab、依那西普、siltuximab、tocilizumab)已被发现可减少自然衰老动物的SASP,防止衰老进展,并改善身体功能。然而,需要进一步的临床研究来确定衰老治疗在人类中的有效性。
9.2 TauO菌株特异性免疫疗法
开发有效的tau免疫疗法在临床试验中被证明具有挑战性,因为许多抗tau抗体产生了阴性结果。目前正在评估semorinemab、bepranemab、E2814、JNJ-63733657、Lu AF87908、APNmAb005、MK-2214、PNT00和PRX005等抗体,但没有一种抗体进入III期试验。针对细胞外tau的tilavonemab和gosuranemab的临床试验也没有显示AD和PSP患者的改善。未来的研究需要探索tau降解体内抗体、细胞内tau的单结构域抗体、多聚集体清除的肽体和脑穿梭等策略,以提高抗体的生物利用度。值得注意的是,tau的菌株特异性免疫疗法仍处于临床前阶段,优化其疗效对于有效靶向和清除tau蛋白病中涉及疾病异质性和认知下降的不同tau蛋白菌株至关重要。

10. 结束语
这篇综述为AD的复杂性和异质性及其潜在机制提供了有价值的见解。作者已经探索了TauO、细胞衰老和脑部炎症的作用。很明显,AD是一种多因素疾病,涉及各种细胞和分子过程的相互作用。TauO的积累,伴随着衰老和脑部炎症,导致神经元功能障碍和认知能力下降(图6)。小胶质细胞和星形胶质细胞发挥作用在维持大脑稳态中起关键作用,但它们在衰老过程中的功能障碍会加剧神经炎症和神经元损伤。展望未来,AD的治疗策略需要考虑疾病的多面性。单独靶向Aβ或tau已显示出有限的成功,突出了探索替代方法的重要性。尽管衰老、SASP或病理性tau蛋白的治疗靶向在临床前研究中显示出前景,但认知方面的切实改善尚未在临床试验中实现。由于人类生物学独特而复杂的方面、意想不到的副作用和许多其他问题,在小鼠身上显示出希望的干预措施往往在临床试验中失败。通过解决疾病病理学的多个方面,联合治疗可以提供一种更全面和有效的方法来减轻脑病理学和认知能力下降。
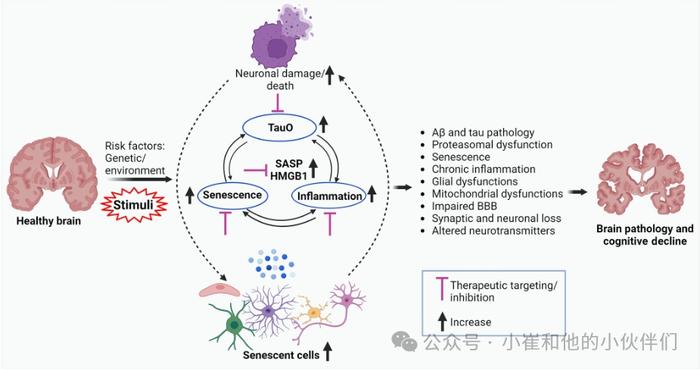
图6:衰老、脑部炎症和TauO在AD中的作用以及潜在治疗靶点
Sagar Gaikwad Sudipta Senapati Md. Anzarul Haque Rakez Kayed.Senescence, brain inflammation, and oligomeric tau drive cognitive decline in Alzheimer’s disease: Evidence from clinical and preclinical studies.Alzheimers Dement. 2024 Jan;20(1):709-727.doi: 10.1002/alz.13490.

编 译:幸嘉伟
校 审:梁春梅


财经自媒体联盟

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有















































 第一财经日报
第一财经日报  每日经济新闻
每日经济新闻  贝壳财经视频
贝壳财经视频  尺度商业
尺度商业  财联社APP
财联社APP  量子位
量子位  财经网
财经网  华商韬略
华商韬略