长期以来,疼痛被认为是一种高度个体化的体验,受到诸多因素的影响,包括情绪状态、期望、注意力集中程度以及过往经历等。这些因素共同作用,影响着个体的疼痛阈值,表明意识活动在一定程度上能够调控疼痛的感知。然而,关于大脑(意识)如何通过下行神经环路调控脊髓(身体)对痛觉输入的处理,我们的理解仍然相对有限。
2025年3月24日,美国国立卫生研究院(NIH)刘元渊研究员联合上海交通大学医学院松江医院周文杰研究员、中国科学院深圳先进技术研究院黄天文研究员团队,在 Neuron 发表了题为A Role for the Pontine Micturition Center in Descending Pain Control的研究论文。该研究首次报道了一个位于脑桥的新型下行痛觉调控中心,该区域可被伤害性刺激激活,进而通过下行神经通路激活脊髓背角中的抑制性神经元,在生理和病理状态下调节热痛和机械痛的上行传递。

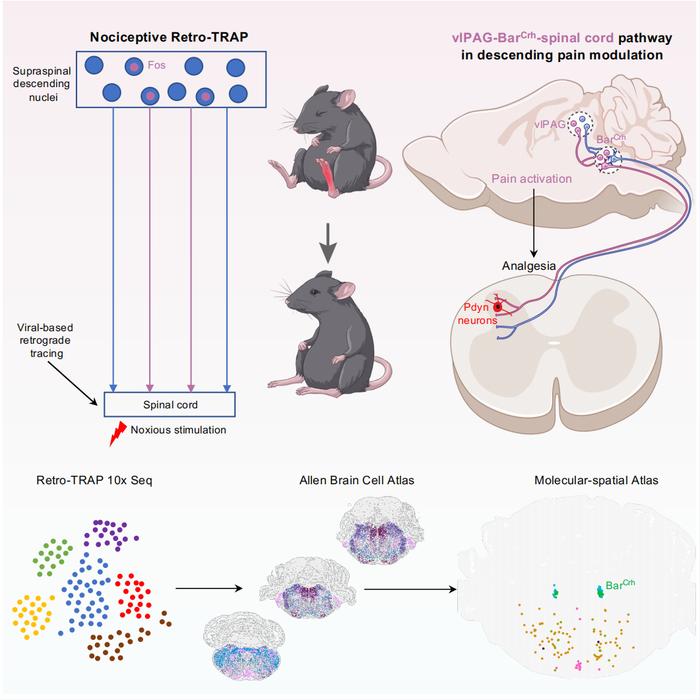
研究团队率先结合活性类群靶向重组技术(targeted recombination in active populations, TRAP)、逆向病毒追踪和单细胞测序技术,系统性地揭示了与疼痛相关的下行环路的分子特征及空间分布。在众多参与疼痛调控的脑区中,研究人员聚焦于脑桥的巴林顿核(Barrington’s nucleus, Bar)。这一核团自被发现以来,长期被视为控制排尿的关键中枢。令人惊讶的是,本研究发现其中表达促肾上腺皮质激素释放激素(CRH, corticotropin releasing hormone)的神经元群(Bar^CRH)对疼痛刺激具有特异性响应。进一步实验证实,激活该神经元群可显著减弱正常状态下的痛觉感知及病理状态下的机械诱发痛;而抑制这些神经元则会导致热痛觉过敏和机械性痛觉超敏。
在探讨该神经环路的上下游机制时,研究团队进一步发现,腹外侧导水管周围灰质(ventrolateral periaqueductal gray, vlPAG)中的疼痛相关神经元可投射并激活 Bar^CRH 神经元,而这些神经元进一步通过下行路径激活脊髓背角的强啡肽能神经元,从而抑制伤害性信号的上行传递,发挥镇痛作用。该发现揭示了一个此前未知的脑桥下行镇痛通路,并为开发新型疼痛治疗策略提供了潜在的干预靶点。
该论文的共同第一作者包括美国国立卫生研究院李天明、上海交通大学医学院松江医院周文杰、中国科学院深圳先进技术研究院柯进。刘元渊研究员(美国国立卫生研究院)、周文杰研究员(上海交通大学医学院松江医院)和黄天文研究员(中国科学院深圳先进技术研究院)为论文的共同通讯作者。本研究还得到了中国科学技术大学张艳教授团队以及上海交通大学徐天乐教授的大力支持与帮助。
 原文链接:
原文链接:https://doi.org/10.1016/j.neuron.2025.02.028


财经自媒体联盟

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有

















































 第一财经日报
第一财经日报  每日经济新闻
每日经济新闻  贝壳财经视频
贝壳财经视频  尺度商业
尺度商业  财联社APP
财联社APP  量子位
量子位  财经网
财经网  华商韬略
华商韬略