3月22日,东南大学生命健康高等研究院执行院长、东南大学附属中大医院耳鼻咽喉头颈外科柴人杰教授联合多家单位在Molecular Therapy(《分子治疗》)上在线发表题为“Combined AAV-mediated specific Gjb2 expression restores hearing in DFNB1 mouse models(联合AAV介导的特异性Gjb2表达恢复DFNB1小鼠模型的听力)”的研究论文。研究人员利用联合AAV系统首次实现DFNB1耳聋小鼠模型全频听力恢复,并且该治疗载体可以有效且安全转导巴马猪和食蟹猴耳蜗,为临床治疗提供了坚实的理论依据。
东南大学附属中大医院柴人杰教授、中国人民解放军总医院杨仕明教授、北京理工大学齐洁玉副教授、复旦大学李耕林教授、东南大学附属中大医院陆玲教授为本论文的共同通讯作者。东南大学博士研究生孙秋寒、东南大学附属中大医院副研究员谈方志、东南大学附属中大医院张李燕博士后、东南大学博士研究生陆宜成、南京大学医学院附属鼓楼医院博士研究生魏浩为本论文的共同第一作者。

耳聋是临床上最常见的致残性疾病,已经严重影响了人类的正常生活,给社会造成了巨大的负担。据WHO报道,全球约有15亿人存在不同程度的听力损失,4.66亿人患残疾性听力损失,占总人口的5%,其中儿童占3400万。由遗传因素导致的耳聋约占60%。Gjb2基因编码缝隙连接蛋白26(Cx26),是非综合征型听力损失(Non-syndromic hearing loss,NSHL)中最常见的致病基因,在常染色体隐性遗传的耳聋患者中,约有50%的患者为Gjb2基因突变引起,Gjb2基因的不同突变可导致常染色体隐性1型耳聋(DFNB1),目前临床上缺乏有效的根治方法。腺相关病毒(Adeno-associated virus,AAV)介导的基因治疗在恢复因OTOF基因突变引起的遗传性耳聋患者听力中展现了优秀的安全性和有效性。因此,亟需开发靶向Gjb2的基因疗法。然而,受限于无高效且特异靶向Gjb2表达细胞的AAV载体,Gjb2的基因疗法研究进展缓慢。
在该研究中,研究人员通过联合使用AAV-ie和AAV1两种衣壳,以及细胞特异性启动子SCpro递送外源Gjb2基因到DFNB1小鼠模型的耳蜗中,在全频段恢复了小鼠听力。Gjb2在耳蜗中广泛表达于多种支持细胞、外侧壁等。研究人员根据Gjb2的表达定位,明确联合AAV-ie和AAV1可以介导Gjb2的高效表达。然而,这两种AAV介导Gjb2在毛细胞中的异位表达会引起耳毒性,导致毛细胞损伤和听力阈值升高,为解决这一问题,研究人员开发了靶向Gjb2表达细胞的特异性启动子SCpro(专利申请号:202310650073.4),既实现了外源Gjb2在小鼠耳蜗中安全、特异地表达于内源性Gjb2阳性细胞中,同时有效避免了Gjb2在毛细胞中的异位表达,从而消除了耳毒性风险。联合AAV1、AAV-ie和特异启动子SCpro驱动外源Gjb2在两种类型的DFNB1小鼠模型中(包括先天性重度耳聋和渐进性耳聋模型)的重新表达显著恢复了耳蜗内电位,成功挽救了两种DFNB1小鼠模型的部分听力。表型上,Gjb2重新表达可减轻DFNB1小鼠耳蜗毛细胞及静纤毛的损伤水平。更为重要的是,联合AAV系统可以有效转导巴马猪耳蜗中内源性Gjb2阳性细胞,且在健康食蟹猴中的内耳局部药物注射表现出良好的听力和全身安全性,提示了其巨大的临床应用潜力。
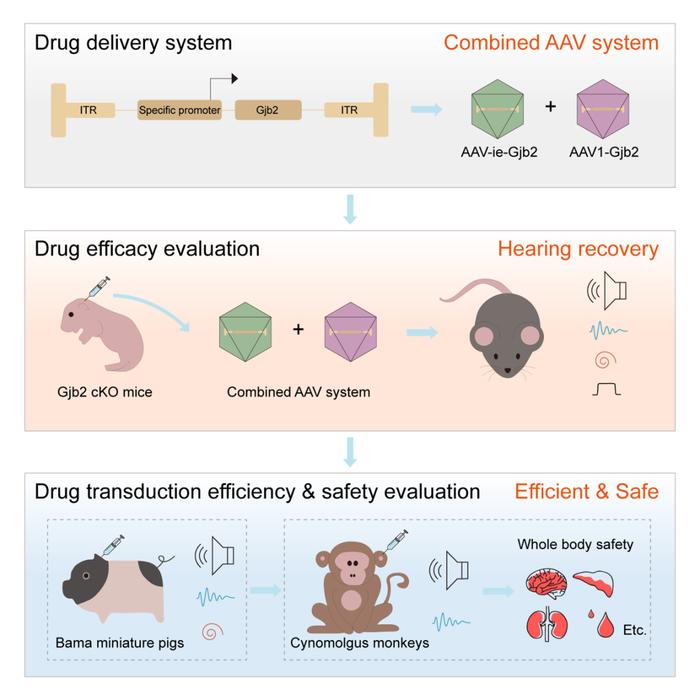
综上,该研究首次在DFNB1小鼠模型中,利用AAV介导的基因治疗实现小鼠全频受损听力恢复,为Gjb2基因治疗药物设计提供了新思路。


财经自媒体联盟

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有














































 第一财经日报
第一财经日报  每日经济新闻
每日经济新闻  贝壳财经视频
贝壳财经视频  尺度商业
尺度商业  财联社APP
财联社APP  量子位
量子位  财经网
财经网  华商韬略
华商韬略