3月21日,首都医科大学宣武医院赵国光教授和任连坤教授团队在神经病学经典期刊Brain上发表了题为 “Structural network-specific effect of extreme capsule stimulation for drug-resistant focal epilepsy”的原创论文,在国际上首次提出并揭示了针对脑深部白质节点进行神经调控治疗癫痫的观点和机制,为深部电刺激调控治疗药物难治性癫痫患者提供了新方向。首都医科大学宣武医院神经内科程岳阳博士、北京航空航天大学医学科学与工程学院王迪助理教授及宣武医院神经外科宣武济南医院张晓华主任医师为本文共同第一作者,首都医科大学宣武医院任连坤教授、赵国光教授为共同通讯作者。

癫痫是严重危害人类健康的常见脑疾病,其中约30%左右患者表现为药物难治性。在精准定位癫痫灶基础上,切除手术是有力的治疗手段。而针对癫痫灶位于重要功能区或者分布弥散从而无法进行手术切除的患者,近年来,深部脑刺激(DBS)作为一种微创、可逆性治疗手段,通过直接电刺激脑深部结构从而调节癫痫活动,具有重要的临床应用价值,是目前研究的热点和重点之一。
国内外应用深部电刺激治疗药物难治性癫痫患者,已取得了一定的临床效果,约60-70%患者发作能够显著减少甚至完全无发作,如何提高疗效是目前面临的瓶颈。目前国际上深部电刺激治疗癫痫的调控靶点均聚焦于脑深部核团,存在不少挑战:脑深部核团基本均参与了多个不同功能神经环路,治疗效果的预测具有复杂性,并有潜在对其他功能的影响;深部电刺激的基础理论是神经网络导向性,但主要基于功能连接选择靶点的个体差异性大,具有一定的不确定性。对于神经核团的长期刺激可能导致神经元的潜在损伤的风险。针对目前国际癫痫治疗的难点,本研究率先提出了脑深部白质节点的调控策略,深入阐明了结构网络约束的神经调控效应。这一研究为癫痫的个体化和精准化治疗提供了新的思路,具有重要的科学意义和临床价值。
脑白质主要由大量神经纤维束组成,是复杂脑功能网络的结构基础。本研究选择位于屏状核与岛叶的最外囊(extreme capsule, EC)作为白质调控靶点,最外囊长纤维包括连接前颞叶与额下回和眶额回的钩束(uncinate fasciculus, UF),连接枕叶及眶额以及额下回等的下前额枕束(Inferior fronto-occipital fasciculus, IFOF),而短纤维通过此区域汇聚连接岛叶。最外囊呈“蝴蝶状”结构,以其前部区域最为集中,形态类似一个瓶颈,为神经调控提供了理想的hub点。
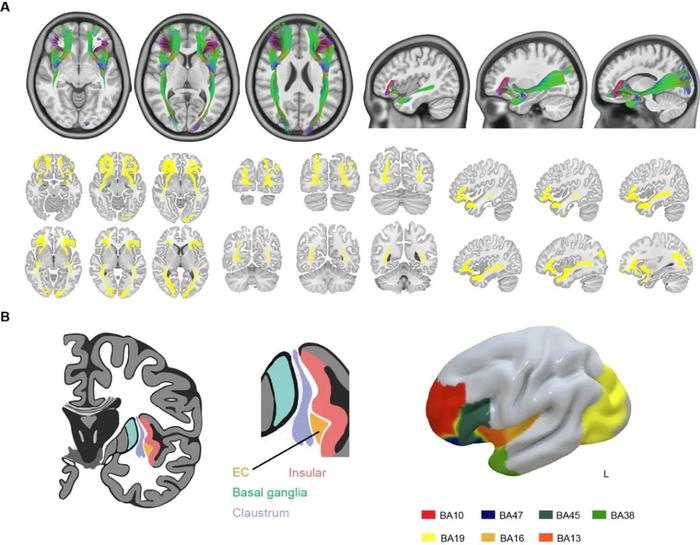
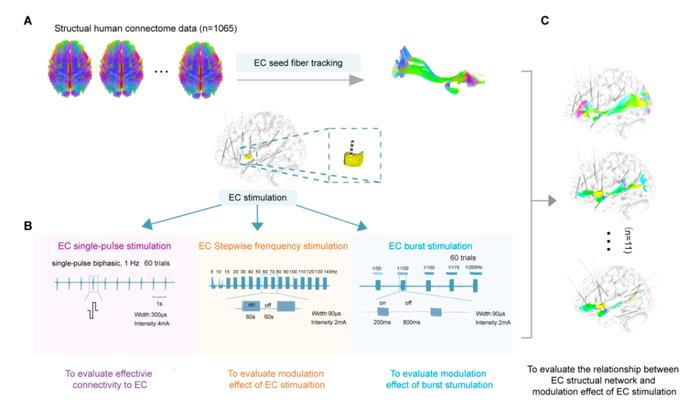
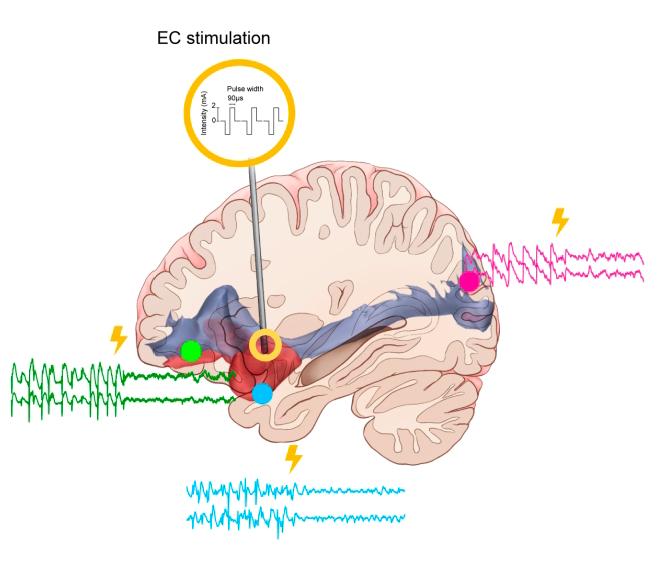
本研究纳入了11名接受SEEG电极植入的药物难治性癫痫患者,同时计划在岛叶置入电极并延伸至最外囊。应用人类结构连接组学数据库,构建个体化最外囊纤维连接网络,应用电生理手段,包括白质—皮质诱发电位评价了最外囊的有效连接分布,结果显示,最外囊与皮层区域之间的有效连接与最外囊结构网络具有高度一致性(包括同侧眶额叶、枕回、额下回、岛叶和颞极);进一步,应用不同频段电刺激,发现最外囊刺激的调控效应具有明显的频率依赖性,低频刺激增加了与最外囊结构连接的皮层区域的神经同步效应,显示高频刺激最外囊对其结构连接的皮质具有去同步化效应,并且能特异性减少最外囊连接皮质内癫痫性放电,提示这种调控效应具有结构连接网络特异性,调节效果受到结构网络的约束。最后,研究初步探索了1 Hz爆发式刺激模式在抑制癫痫发作方面的效果,结果显示其出与传统高频刺激相当的效果。
本研究在临床角度,首次提出并揭示了最外囊作为深部电刺激神经调控治疗癫痫的观点,并进行了机制验证,为治疗癫痫发作起源于最外囊连接网络的癫痫类型(前颞叶、岛叶、眶额皮质等)提供了临床转化应用的证据。在理论角度,在目前的国际上深部电刺激聚焦于灰质核团调控之外,开创性提出针对脑深部白质节点的调控治疗,揭示了结构网络约束的神经调控效应,完善了目前癫痫深部电刺激的理论体系。为癫痫治疗的个体化和精准化提供理论支持,而新的调控模式的探索,为临床转化研究和临床应用提供了更多的选择。
本研究得到了北京市医院管理中心临床医学发展专项 “扬帆”计划,十四五国家重点研发计划等基金支持。


财经自媒体联盟

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有














































 第一财经日报
第一财经日报  每日经济新闻
每日经济新闻  贝壳财经视频
贝壳财经视频  尺度商业
尺度商业  财联社APP
财联社APP  量子位
量子位  财经网
财经网  华商韬略
华商韬略