来源:生命科学前沿
姜新义,山东大学教授、药剂学博士生导师,入选国家优秀青年人才项目,山东省高校“智能材料与药物递送”青创团队带头人,山东大学杰出中青年学者,山东大学“齐鲁青年学者”,山东大学药学院“智能材料与药物精准递送”团队PI。2002年-2006年,山东中医药大学,学士;2006年-2009年,中国药科大学,硕士;2009年-2012年,复旦大学 药学院,博士;2012年-2013年,江苏大学药学院,讲师;2013年-2017年,斯坦福大学 医学院,博士后研究员;2017年-至今, 山东大学 药学院,教授。2024年获国家杰出青年科学基金。
 姜新义教授
姜新义教授姜教授的研究方向为功能材料与核酸递送系统开发与应用;基于纳米医学的疾病诊断与治疗创新策略;基于纳米医学的疾病诊断与治疗创新策略;基于纳米医学的疾病诊断与治疗创新策略。已在Nature Nanotechnology,Science Translational Medicine,Nature Communications,PNAS,Science Advances,Advanced Materials,ACS Nano等学术期刊上发表研论文50余篇;申报国家发明专利 20余项、PCT专利3项,10项已获授权,9项已转让。应邀在国际控释协会、中国药学大会、生物医学工程BMES等国内外学术会议上做口头报告30余次,先后获得国际先进材料协会科学家奖(2021),入选国际先进材料协会会士(2022),山东省医学科技二等奖;指导研究生获得全国药学专业学位研究生优秀学位论文,山东省研究生优秀成果一等奖等荣誉。在此,我们汇总了屈教授的代表性论文与大家一起分享,内容如下,
Nat. Nanotech.(ESI高被引论文):抑制肿瘤复发的免疫增强水凝胶

免疫治疗为癌症治疗带来了前所未有的改变和希望,FDA已批准PD-1/PD-L1及CTLA4等多款单抗药物用于多种恶性肿瘤的临床干预和治疗,并获得令人满意的疗效。然而,目前尚没有针对恶性脑肿瘤尤其是多形性神经胶质母细胞瘤(GBM)成功的免疫治疗方案。GBM肿瘤微环境高度复杂,多重因素限制了GBM免疫治疗策略的开发,其中细胞毒性T细胞匮乏和免疫抑制型细胞(如Treg)聚集是制约GBM免疫治疗的主要因素之一。IDH1和IDO1是两种典型的与免疫抑制相关的生物标志物,通过深入的生物信息学分析和数据挖掘,人们发现两者mRNA在GBM患者肿瘤组织中均呈现高表达,而且两者均表现出与患者生存期负相关性。通过GBM患者临床样本分析,人们进一步确证了肿瘤组织IDH1和IDO1的表达水平明显高于癌旁正常脑组织。IDH1突变可下调IFN-γ诱导型趋化因子CXCL10,从而降低对活化T细胞的招募,导致活化T细胞不能高效进入中枢神经系统。IDO1可促进色氨酸向犬尿氨酸的转变,增加免疫抑制型Treg细胞在肿瘤组织的聚集。通过沉默IDO1调控肿瘤氨基酸代谢,可缓解Treg细胞相关的免疫抑制作用。
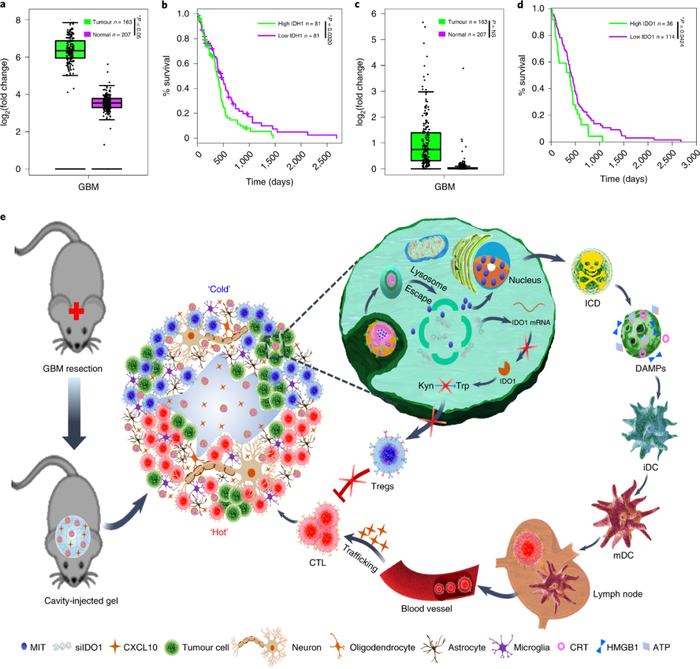
有鉴于此,山东大学姜新义教授等人报导了一种可注射自组装寡肽水凝胶系统,该系统能够在手术切除GBM后,刺激杀瘤免疫,降低复发的可能。该水凝胶包括1)肿瘤归巢免疫纳米调节剂(THINR),可诱导免疫原性细胞死亡和抑制吲哚胺2,3-双加氧酶-1(indoleamine 2,3-dioxygenase-1);2)CXC趋化因子配体-10用于持续性的T细胞浸润。当注射进入被切除的肿瘤腔内后,前驱体溶液凝胶化,变成水凝胶,释放封装的THINR和CXCL10的自组装寡肽水凝胶系统模拟热肿瘤免疫位来攻击残留的肿瘤细胞。游离的THINR跟踪并主动靶渗入脑实质的手术残留肿瘤细胞。内在的纳米载体随后在内体酸性刺激下分解,释放MIT和siIDO1,在肿瘤细胞中发挥免疫调节作用,进而激活循环中的T细胞并缓解Treg相关的免疫制动。然后,通过持续释放CXCL10将活化的T细胞募集到CNS中,以攻击手术残留的肿瘤细胞。通过模拟热肿瘤免疫位来探讨术后胶质瘤复发的消退,从而探索了可注射水凝胶系统的多功能性。该研究为GBM患者提供了一种有效的杀瘤免疫的替代策略,可能在手术干预后的“冷”肿瘤免疫治疗中有广泛的影响。
文献链接:https://www.nature.com/articles/s41565-020-00843-7
Sci. Translational Med. (ESI高被引论文):脑胶质瘤干细胞特异性CAR巨噬细胞的腔内生成为术后胶质母细胞瘤治疗启动局部免疫

多形性胶质母细胞瘤(GBM)是恶性程度最高的中枢神经系统肿瘤,外科手术切除是GBM病人临床治疗最基础的干预手段,GBM病人术后一般采用放疗、化疗相结合方式清除残余肿瘤细胞,而其中脑胶质瘤干细胞(GSCs)作为脑肿瘤的“种子细胞”,对放、化疗不敏感,难以清除。GBM病人手术切除实体瘤部分后,残留的GSCs很快复苏、增殖、分化,导致脑肿瘤在几个月内迅速复发。探索“特异”清除GSCs的有效策略是防止GBM术后复发的关键。巨噬细胞(MΦ)作为固有免疫细胞,参与多种免疫相关疾病的调节,与T细胞“分泌”为主的胞毒作用不同,巨噬细胞主要起到胞吞、加工和抗原递呈作用;与T细胞相比,巨噬细胞能更好地争夺氧气和营养,活力更强。
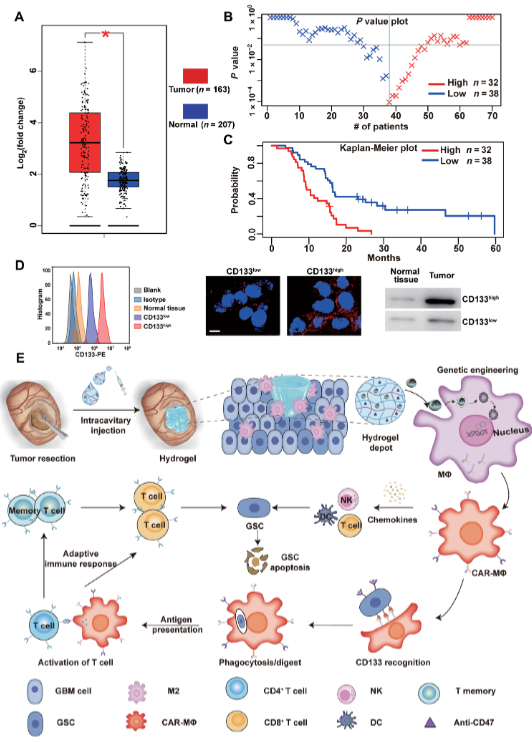
外科手术切除是GBM病人临床治疗最基础的干预手段,手术所致物理创伤会在术后瘤腔周围“局部”加剧炎症因子释放,使得在术后瘤腔“局部”富集大量小胶质/巨噬细胞。由此,山东大学姜新义教授和威斯康星大学麦迪逊分校Quanyin Hu提出假说若能“原位改造”这些小胶质/巨噬细胞生成CAR-MΦ,使其能特异性识别、吞噬GSCs,发挥抗原递呈作用,进而激活适应性免疫系统,形成免疫记忆,有望解决GSCs引起的术后GBM复发难题。此外,通过生物信息学分析,作者发现CD133在GBM患者的胶质瘤组织中高度表达,进而构建了巨噬细胞特异性启动子驱动的抗CD133 CAR质粒(pCAR)。因此,该研究利用课题组开发的可注射水凝胶“药物贮库”系统,在GBM术后瘤腔内以“填充形式”共递送MΦ靶向编辑纳米载体(pCAR-NPs)和CD47抗体,对术后瘤腔周围“局部”MΦ进行原位编辑,在瘤腔周围生成可靶向清除GSCs的CAR-MΦ;同时,通过阻断肿瘤“别吃我”信号,协同增强CAR-MΦ对GSCs吞噬效率,利用其抗原递呈作用激活适应性免疫系统,清除术后残余的GSCs,形成免疫记忆,避免脑胶质瘤复发。
文献链接:https://www.science.org/doi/10.1126/scitranslmed.abn1128
Nat. Commun.:基于仿胞葬作用的重塑RA免疫稳态新策略

类风湿性关节炎(RA)是一种病因未明的、以炎性滑膜炎为主的慢性系统性自身免疫性疾病,其特征是关节免疫功能障碍,关节内滑膜增生破坏关节和关节软骨,从而使患者出现关节肿胀疼痛、强直和畸形。目前RA临床治疗多采用免疫抑制剂缓解炎性免疫微环境,然而,数据显示有三分之一RA患者未能得到有效缓解。RA发病机制涉及复杂炎症网络,包括多种细胞因子和炎症细胞相互作用,其中,滑膜炎性巨噬细胞(SIMs)可释放活性氧(ROS)和多种促炎因子,在调控RA炎性微环境方面发挥了关键作用,被认为是关节免疫功能障碍、滑膜炎和最终关节糜烂的重要诱导因素。依据抗瓜氨酸蛋白抗体(ACPA)表达水平,RA病人可分为ACPA+型和ACPA-型,其中ACPA+型约占RA病例的三分之二,具有更严重的病理表现。生物信息学分析表明干扰素调节因子5 (IRF5)的表达与RA滑膜中ACPA表达呈正相关。作为巨噬细胞炎症表型的主要转录调节因子,IRF5在RA滑膜中参与多种SIMs相关炎症信号的表达。靶向沉默SIMs中IRF5,原位重编程SIMs向抑炎表型转化,可终止ACPA+ RA中SIMs诱导的病理级联,可能是调控关节免疫稳态,治疗RA的有效策略。
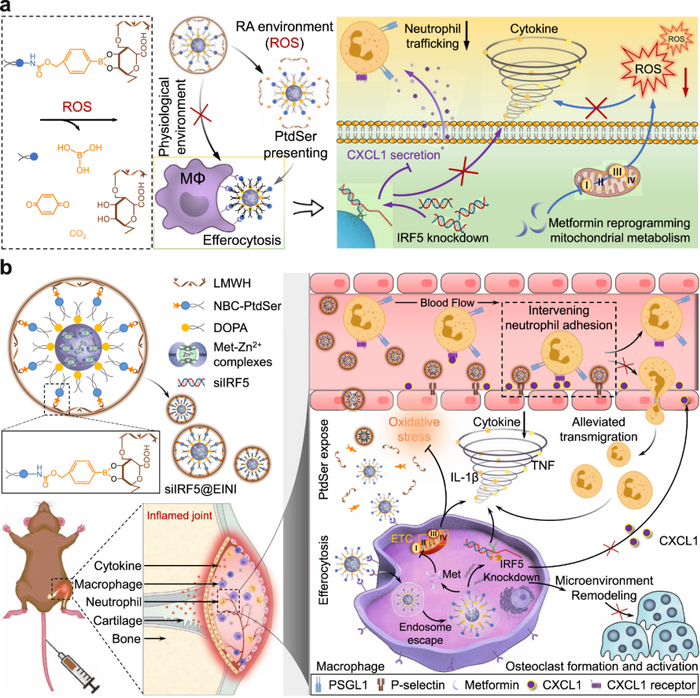
受“胞葬”作用启示,山东大学姜新义教授/张元凯教授等人制备了一种可释放“eat-me”信号的核酸药物纳米递送载体。该药物递送载体包括具有活性氧(ROS)响应性的磷脂酰丝氨酸 (PtdSer)脂质层和具有P-选择素阻断基序的低分子量肝素 (LMWH)外壳,通过层层自组装技术将靶向沉默IRF5的小干扰RNA(siIRF5)包裹,形成具有仿“胞葬”作用的核酸药物纳米递送载体 (siIRF5-carrying efferocytosis-informed nanoimitator, siIRF5@EINI)。系统给药后,LMWH外壳可延长siIRF5@EINI 血液循环时间、增强炎症区滞留,同时拮抗P-选择素受体减少中性粒细胞关节浸润;到达RA 病灶后,上调的 ROS 会触发LMWH壳脱落,暴露PtdSer。作为“胞葬”作用的关键信号分子,PtdSer通过“eat-me”信号介导SIMs对siIRF5的靶向内化,使siIRF5@EINI以类似“胞葬”作用的方式被SIMs内吞。RA小鼠模型实验证明,siIRF5@EINI可通过阻断中性粒细胞浸润和诱导SIMs抑炎表型转化,终止SIMs启动的病理级联,重塑关节内免疫稳态,保护软骨,缓解动物模型类风湿性关节炎病理特征。结果表明通过仿“胞葬”作用的递药策略可重塑RA病灶部位免疫稳态,为RA可逆治疗提供了新思路;该策略对巨噬细胞过渡激活引起的其他自身免疫性疾病(如动脉粥样硬化、炎症性肠病,红斑狼疮等)的治疗也有一定启示作用。
文献链接:https://www.nature.com/articles/s41467-023-36468-2
Nat. Commun.:细菌疗法通过激发杀瘤免疫抑制脑胶质瘤复发

多形性胶质母细胞瘤(GBM)是一种高度侵袭性的脑肿瘤,其特征是侵袭行为和免疫反应受损,给治疗带来挑战。GBM的外科揭穿未能解决其高度浸润性,使肿瘤卫星处于免疫监测受损的环境中,最终为肿瘤复发铺平了道路。通过增强抗肿瘤免疫来追踪和根除残留的GBM细胞对于预防术后复发至关重要,但有效的免疫治疗策略仍然难以捉摸。
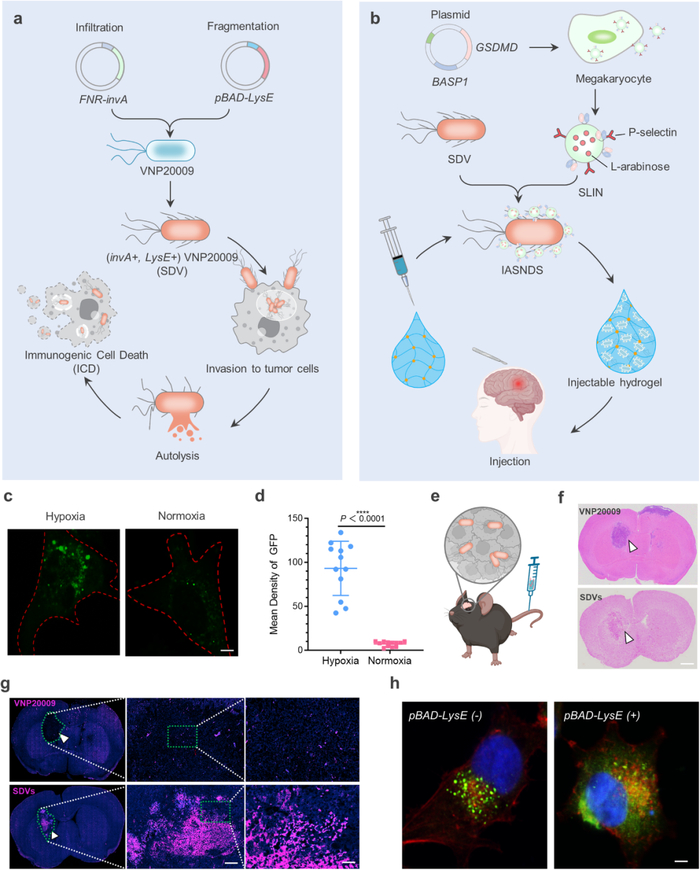
微生物,尤其是革兰氏阴性菌,具有通过与吞噬细胞的Toll样受体(TLRs)和核苷酸结合寡聚受体(NLRs)结合来触发抗肿瘤免疫反应的能力。值得注意的是,细菌疗法刺激先天免疫已成为缓解肿瘤特异性免疫抑制微环境的有效策略。颅内细菌感染促进免疫细胞募集和激活,基于细菌的免疫细胞募集策略对于克服GBM的“冷”微环境是可行的。GBM浸润细菌还可以通过细菌肽向T细胞呈递肿瘤相关抗原来激活适应性免疫。在此基础上,山东大学倪石磊教授、姜新义教授和Chen Chen等人报道了一种空腔可注射细菌水凝胶超结构,其可靶向空腔周围的GBM卫星细胞(GBM satellites),触发GBM焦亡,并启动先天和适应性免疫反应,从而防止雄性小鼠术后GBM复发。由减毒鼠伤寒沙门氏菌(VNP20009)改造的免疫刺激性沙门氏菌递送载体(SDV)寻找并攻击GBM细胞。VNP20009具有激活先天免疫和适应性免疫的双重能力。然而,颅内细菌治疗的研究受到限制,主要是由于担心使用细菌引起感染。为此,作者将可触发沙门氏菌自溶的纳米胶囊(SLIN)与沙门氏菌递送载体(SDV)表面相连,设计了免疫刺激自溶沙门氏菌-纳米胶囊递送系统(IASNDS),通过细胞内释放细菌成分引发抗肿瘤免疫反应。因此,该工作提供了一种刺激抗GBM免疫的局部细菌疗法,对面临高复发风险的恶性肿瘤患者具有潜在的适用性。
文献链接:https://www.nature.com/articles/s41467-024-48606-5
Sci. Adv.:可吸入穿透黏液的脂质纳米颗粒对小鼠肺纤维化的治疗作用

特发性肺纤维化(IPF)是了一种慢性进行性肺部疾病,会导致永久性肺功能丧失和纤维化重塑。肺泡的维持和损伤后的成功再生依赖于健康的肺泡2型上皮(AT2)细胞。AT2细胞更新受损已成为肺泡稳态失调的核心因素,引发病理性上皮重塑,涉及成纤维细胞的募集和激活,最终导致细胞外基质(ECM)的积聚和肺结构的扭曲。深入的研究表明,AT2细胞起着兼性干细胞的作用,能够通过增殖或诱导定向分化为肺泡1型上皮(AT1)细胞来再生受损的肺泡。考虑到AT2细胞在IPF进展中的关键作用,维持AT2干细胞的特性以促进真正的极化被认为是一种有前景的治疗策略。
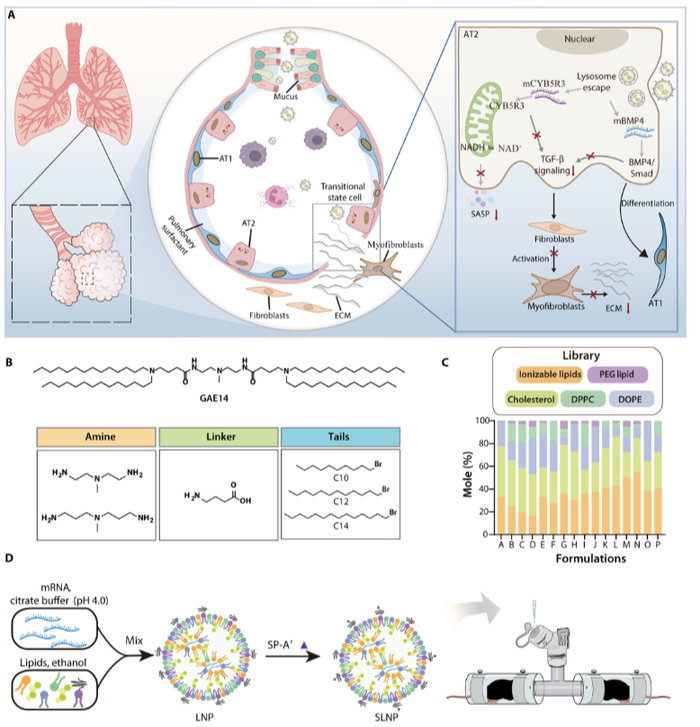
山东大学姜新义教授等人报告了一种可吸入的粘液穿透脂质纳米颗粒(LNP),用于共同递送双mRNAs,通过恢复AT2的干性来促进IPF治疗的真正极化。可吸入的LNPs最初是用二棕榈酰磷脂酰胆碱和自制的可电离脂质配制而成的,可用于高效的肺粘液渗透和双信使RNA(mRNAs)的协同递送,这些mRNAs可分别编码细胞色素b5还原酶3和骨形态发生蛋白4。在博莱霉素模型中吸入后,LNPs通过改善烟酰胺腺嘌呤二核苷酸的生物合成来逆转线粒体功能障碍,从而抑制AT2细胞的加速衰老。同时,受损AT2细胞诱导的病理性上皮重塑和成纤维细胞活化被终止,最终促进肺泡再生。研究数据表明,mRNA LNP系统在肺上皮细胞中表现出高蛋白表达,显著缓解了肺泡塌陷,延长了纤维化小鼠的存活时间,为对抗IPF提供了一种临床可行的策略。
文献链接:https://www.science.org/doi/10.1126/sciadv.ado4791
Sci. Adv.:基于在体编辑CAR-巨噬细胞治疗假体周围感染新策略

假体周围关节感染(PJI)是关节置换术后最具破坏性的并发症之一,被认为是一项巨大的临床挑战。目前PJI的临床治疗仍靠多次手术翻修和长期的抗菌治疗。然而,近年来,在预防和根除PJI方面几乎没有取得临床进展。PJI发病机制涉及复杂的免疫微环境,包括多种病原体和炎症细胞相互作用,其中,金黄色葡萄球菌,尤其是耐甲氧西林金黄色葡萄球菌,仍然被认为是最普遍和最具破坏性的致病病原体。巨噬细胞(Mφs)对金黄色葡萄球菌的先天免疫反应至关重要,并且在将病原体内化后激发其大部分抗菌活性。然而,Mφs的免疫防御机制通常在假体周围免疫微环境中受到抑制。此外,细胞内的金黄色葡萄球菌能够触发半胱天冬酶11 (Caspase-11) 的激活来劫持巨噬细胞的线粒体,从而抑制活性氧 (mROS)介导的巨噬细胞胞内杀菌作用,使金黄色葡萄球菌能够实现在Mφs内的免疫逃逸。
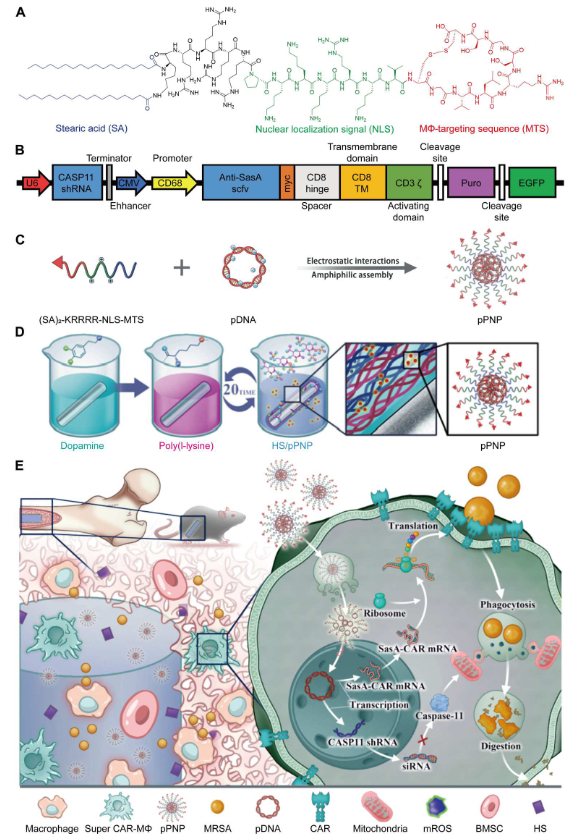
考虑到Mφs独特的效应功能和对细菌的天然趋化性,山东大学姜新义、李伟教授团队设计并制备了一种可原位编辑假体周围Mφs(CAR-巨噬细胞)的核酸药物纳米递送涂层。通过正负电荷相互吸引层层组装形成的多肽纳米(PNP)递送涂层, 其中,PNP负载有金黄色葡萄球菌特异性嵌合抗原受体和增强巨噬细胞胞内杀菌能力的shRNA质粒;自组装涂层中含有促成骨能力的硫酸乙酰肝素(HS)。研究结果显示该纳米涂层使假体周围产生CAR-巨噬细胞,高效靶向并清除金黄色葡萄球菌,同时促进骨-种植体界面的快速骨整合。负载核酸药物纳米递送涂层的植入物植入体内后,PNP表面的巨噬细胞靶向肽能够迅速靶向局部微环境中的巨噬细胞,实现对巨噬细胞的原位编辑,使其高效表达金黄色葡萄球菌特异性嵌合抗原受体和增强胞内杀菌能力的发卡RNA,实现CAR-巨噬细胞对金黄色葡萄球菌的高效靶向、快速内吞和胞内清除。同时,涂层缓释的HS也能够促进假体表面的快速成骨,加速骨整合过程。这些结果为患有 PJI或耐药细菌感染的患者提供更有效的宿主导向免疫治疗策略,值得在临床试验中进一步评估。
文献链接:https://www.science.org/doi/10.1126/sciadv.adg3365
Adv. Mater.:腔内喷涂纳米调节剂包裹的水凝胶可用于术后胶质母细胞瘤免疫治疗

众所周知,多形性胶质母细胞瘤(GBM)由于其复杂的肿瘤微环境(TME)而对免疫治疗具有抵抗力。胆固醇代谢失调与免疫抑制性肿瘤微环境有关,并促进肿瘤进展。在这项研究中,山东大学姜新义/陈晨/赵坤/张彩等人发现GBM组织中的胆固醇水平异常高,而胶质瘤支持性巨噬细胞(GSMs)作为重要的“胆固醇工厂”,表现出异常活跃的胆固醇代谢和外流,提供胆固醇来促进GBM生长并诱导CD8+T细胞耗竭。因此,该研究报道了一种腔内可喷雾纳米调节剂包裹的水凝胶系统来调节GSMs的胆固醇代谢。可降解纳米调节剂介导的GSMs中DHCR7的消融有效抑制了胆固醇供应并激活了T细胞免疫。此外,Toll样受体7/8(TLR7/8)激动剂的组合显著促进GSMs极化为抗肿瘤表型,并改善免疫抑制性TME。混合系统治疗在原位GBM肿瘤模型和术后复发模型中表现出优异的抗肿瘤效果。总而言之,该研究结果揭示了GSMsDHCR7/胆固醇信号在免疫抑制性TME调节中的作用,提出了一种潜在的GBM治疗策略,值得进一步的临床试验。
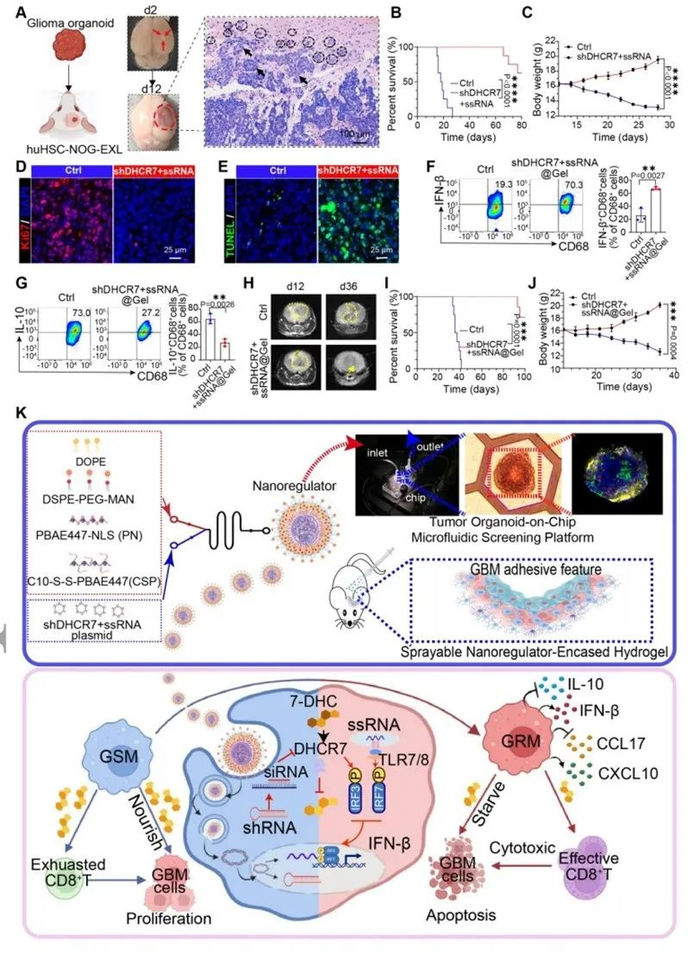
文献链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202311109
Adv. Mater.:可降解载药微针用于抑制胶质母细胞瘤术后复发

胶质母细胞瘤(GBM)是一种高度恶性的侵袭性脑肿瘤,由于其浸润性生长,肿瘤与正常脑组织边界不清,难以通过手术彻底切除。超过90%的GBM患者会在手术切缘2-3厘米范围内复发,严重影响患者预后,导致术后5年生存率不足8%。因此,如何克服术后复发是GBM临床治疗中的关键问题。
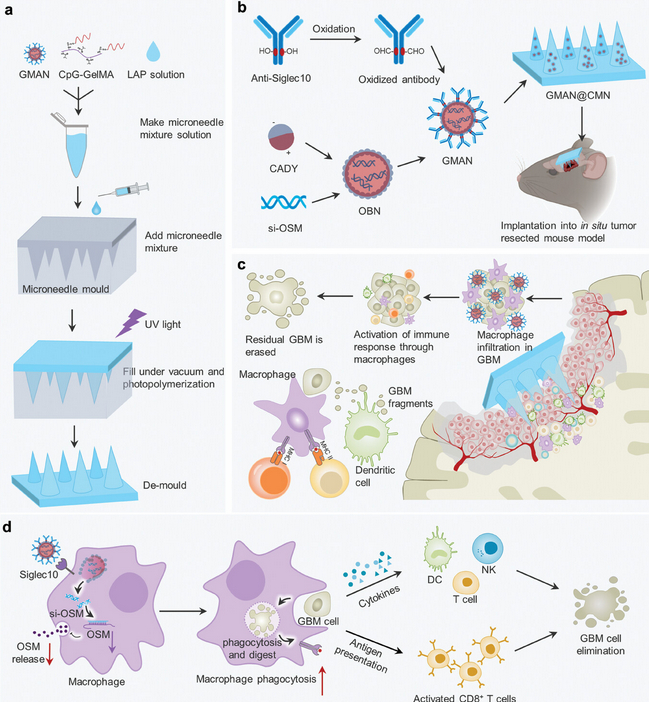
山东大学齐鲁医院倪石磊、张玉霖团队联合山东大学姜新义团队、山东大学齐鲁医院徐峰团队通过合成巨噬细胞激活纳米颗粒(GMAN)阻断CD24-Siglec10“别吃我”信号通路,有效促进了巨噬细胞对肿瘤细胞的识别和吞噬。同时,联合抑制巨噬细胞表达抑瘤素M (Oncostatin M, OSM),实现了逆转肿瘤术后局部的免疫抑制微环境。为实现颅内应用,该团队进一步合成了生物可降解微针,通过偶联免疫佐剂CpG寡核苷酸,达到了募集免疫细胞抵达局部以产生抗肿瘤免疫反应的效果。最终,通过在术腔壁贴附该免疫激活微针实现了抑制GBM术后局部复发的目的。这项研究通过颅内可植入微针,高效地在局部递送纳米药物,为局部高复发的恶性肿瘤提供了新的治疗理念。此外,该研究也为该类型肿瘤治疗提供了基于激活固有免疫克服肿瘤局部免疫抑制策略的实践指导。
文献链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202409857
ACS Nano:携带mRNA的脂质纳米颗粒可实现原位CAR -巨噬细胞工程化并根除脓毒症小鼠模型中的多重耐药细菌

脓毒症是急性感染最严重的临床表现,死亡率高于癌症,是全球公共卫生的一大负担。持续的耐甲氧西林金黄色葡萄球菌(MRSA)感染和进一步的宿主免疫麻痹是脓毒症相关死亡的主要原因,但目前针对脓毒症的临床干预措施未能有效恢复免疫稳态,从而彻底根除MRSA。
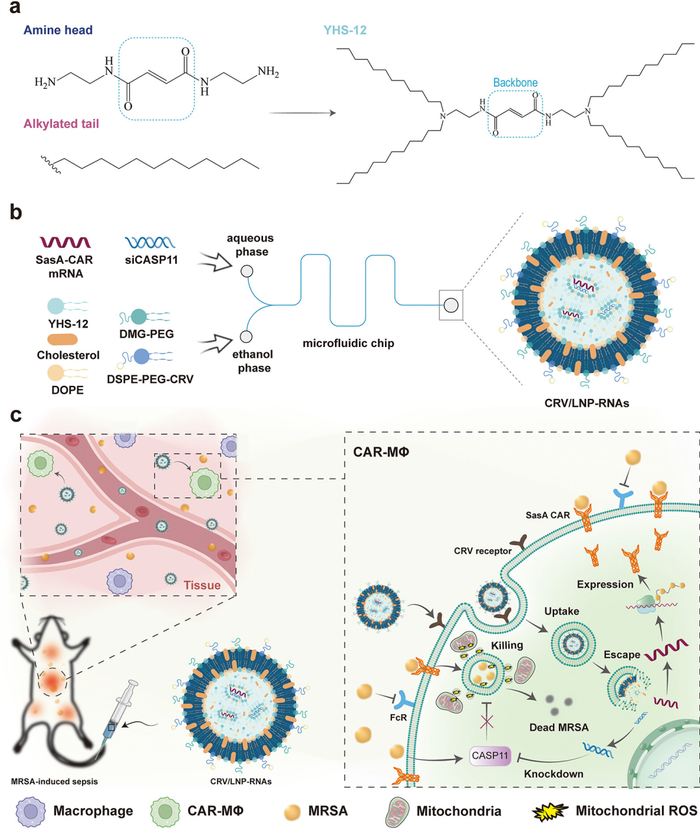
为了更有效地刺激抗MRSA的先天免疫,山东大学姜新义教授等人开发了MΦ靶向CRV肽修饰的脂质纳米粒(CRV/LNP-RNA),用于巨噬细胞(MΦ)的瞬时原位编程。其中,作者设计了一种内源性富马酸衍生的可电离脂质纳米材料。CRV/LNP-RNA能够将MRSA靶向嵌合抗原受体(CAR)mRNA(SasA CAR mRNA)和CASP11(一种关键的MRSA细胞内逃逸靶点)siRNA原位递送到MΦs,从而产生具有增强杀菌效力的CAR-MΦs。上述LNPs能够在静脉注射后将核酸选择性引入MΦ细胞质,导致MΦs中CAR表达和CASP11敲除。这些工程CAR MΦ有效地吞噬细胞外MRSA并阻断其细胞内逃逸机制,从而消除MRSA细菌。进一步的实验研究结果表明,工程化的MΦ可以在细胞内有效地吞噬和消化MRSA,防止“超级细菌”MRSA的免疫逃逸。该发现强调了纳米粒子在体内产生CAR-MΦ作为多药耐药(MDR)细菌感染治疗平台的潜力。
文献链接:https://pubs.acs.org/doi/10.1021/acsnano.3c10109

4001102288 欢迎批评指正
All Rights Reserved 新浪公司 版权所有

