溃疡性结肠炎是一种影响大肠的慢性炎症性疾病,引起腹泻、出血和尿急等症状。目前针对这种情况的治疗选择有限,导致许多患者对现有疗法应答不足或不耐受。该疾病的确切病因尚不完全清楚,但据信是由环境因素引发的遗传易感个体的异常免疫反应引起的。礼来的药物Omvoh(mirikizumab,米吉珠单抗)是该病治疗领域的重要补充,该药物已在部分国家获批上市。
根据6月29日《新英格兰医学杂志》发表的一项研究,在中度至重度活动期溃疡性结肠炎患者中,mirikizumab比安慰剂更能有效诱导和维持临床缓解。该研究由生产mirikizumab的礼来公司资助。
阿姆斯特丹大学医学中心的Geert D’Haens博士及其同事对患有中度至重度活动期溃疡性结肠炎的成年人进行了两项3期随机安慰剂对照试验。
在诱导试验LUCENT-1中,共有1281名患者以3:1的比例随机分配,每4周接受一次mirikizumab(300mg)或安慰剂治疗,持续12周。在维持试验LUCENT-2中,544名对mirikizumab诱导有应答的患者被随机分配接受mirikizumab(200mg)或安慰剂,每4周按2:1的比例接受治疗,持续40周。
研究人员发现,在诱导试验的第12周,与安慰剂组相比,mirikizumab组中临床缓解的患者比例显著更高(24.2% vs 13.3%);维持试验第40周也出现了类似的结果(49.9% vs 25.1%)。两项试验均符合所有主要次要终点的标准。
与安慰剂相比,mirikizumab更容易发生鼻咽炎和关节痛的不良事件。在两项试验的对照期和非对照期接受mirikizumab治疗的1217名患者中,有15名出现机会性感染。两项试验中最常见的不良反应是上呼吸道感染(7.9%,最常见的是鼻咽炎)、头痛(3.3%)、皮疹(1.1%)和注射部位反应(8.7%,皮下注射,LUCENT-2)。
研究作者写道:“在这两项3期试验中,我们发现,在12周和24周的时间内,mirikizumab疗法在疾病的临床、症状、内窥镜和组织学测量的诱导和维持阶段均有效。”
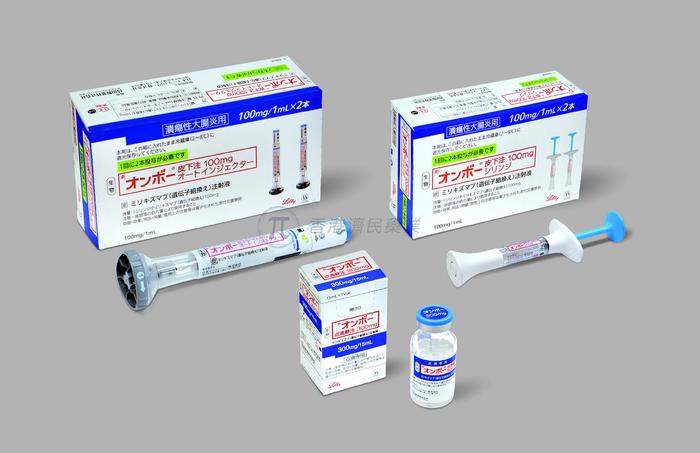
礼来公司表示,Mirikizumab是第一个白细胞介素(IL)-23p19靶向生物制剂,已证明对中度至重度活动期UC的诱导和维持治疗有效。
在日本,mirikizumab于今年初获得批准,作为中度至重度活动期溃疡性结肠炎成人的首创治疗药物。
此外,欧洲药品管理局(EMA)人用药品委员会(CHMP)对mirikizumab作为对常规治疗或生物治疗应答不足、应答消失或不耐受的中度至重度活动期溃疡性结肠炎成年患者的首选治疗方案发表了积极意见。欧盟委员会于2023年5月26日授予mirikizumab的上市许可。
6月底,基于LUCENT-1和LUCENT-2III期试验的成功结果,mirikizumab也获得了英国的批准。
不过在美国,FDA于4月份针对mirikizumab治疗溃疡性结肠炎的生物制品许可申请(BLA)发出了完整的回复函。FDA在信中提到了与拟生产mirikizumab相关的问题,但并不担心该药物的临床数据包、安全性或标签。
礼来公司表示,将继续与FDA合作,以尽快将其推向市场。预计2023年全球其他市场将做出监管决定。
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指引,请咨询主治医师。


财经自媒体联盟

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有















































 第一财经日报
第一财经日报  每日经济新闻
每日经济新闻  贝壳财经视频
贝壳财经视频  尺度商业
尺度商业  财联社APP
财联社APP  量子位
量子位  财经网
财经网  华商韬略
华商韬略