目前,在明显早产儿研究中,关于塑造肠道微生物组发展的宿主和环境因素不太明确。在足月婴儿中,出生方式和接受母乳是影响第一年肠道微生物组的主要因素,但关于早产儿的相关研究产生了不一致的结果。在没有坏死性小肠结肠炎(necrotizing enterocolitis,NEC)或晚发性败血症(necrotizing enterocolitis,LOS)等肠道疾病的情况下,需要对影响早产儿正常肠道微生物组结构(preterm gut community types,PGCTs)和功能的因素进行重点研究。
早产儿最初在新生儿重症监护室(neonatal intensive care unit,NICU)接受护理,这个独特的环境在肠道微生物组的获得和发展中起着关键作用。在早产儿中,探索益生菌对肠道微生物群发育影响的研究很少,但有研究已经表明双歧杆菌属能够在肠道内长期定居。本研究中,对没有肠道疾病或LOS的早产儿进行研究,目的是:(1)表征早产儿肠道微生物组在NICU期间的纵向发育特点。(2)确定协变量对早期生命关键时期发育中的细菌群落和功能的影响。
2022年9月,美国芝加哥大学Christopher J. Stewart、Janet E Berrington课题组在Nature Microbiology(IF:30.964)发表了题为“Strain-specific impacts of probiotics are a significant driver of gut microbiome development in very preterm infants”的文章,作者以早产儿粪便为研究对象,运用宏基因组、转录组学、非靶向代谢组学等组学研究方法重点阐述了益生菌对菌株的特异性影响对早产儿肠道微生物组发育的影响,其中一些与影响足月婴儿的因素重叠。结果突出了益生菌产品中菌株特异性差异的重要性,及其对早产儿肠道中宿主的相互作用影响。

研究思路

主要内容
首先对123名妊娠宏基因组分析,大多数婴儿(92.7%)在某个时候会接受一些母乳(mothers’ own milk,MOM),随着年龄的增长,婴儿开始接受配方奶粉。所有样本都曾接触过奶(MOM、配方奶或两者都有,图1a)和抗生素。为了包括益生菌引入前的婴儿,本研究中的队列是在10年内收治的,涵盖了益生菌引入前和两次连续使用益生菌期间。实验中,一组没有接触益生菌,两组分别给予不同的益生菌产品:Infloran(双歧杆菌和嗜酸乳杆菌)或Labinic(双歧杆菌、长芽孢杆菌亚种和嗜酸乳杆菌)。
1.分类概述
总共在样品中鉴定出394种细菌。物种丰富度在出生后前10天略有下降,这与需氧细菌的损失相对应(图1b)。第十天之后,物种丰富度持续增加,直到婴儿离开NICU。此外,香农多样性从出生时到第45天呈指数增长,从第45天开始略有增加(图1b)。从出生到第80天,专性厌氧菌的相对丰度普遍增加(图1c)。双歧杆菌(放线菌门)的相对丰度从出生到出院逐渐增加,从第30天开始是最丰富的属。埃希氏杆菌属和克雷伯氏杆菌属,都是革兰氏阴性菌变形菌门的生物,在出生后第一个月相对丰度增加,然后逐渐下降(图1d,e,f)。根据狄利克雷的细菌物种多项式混合物(Dirichlet’s multinomial mixture,DMM)模型确定了五个簇是最佳的,在本研究中它们称为PGCTs,PGCT根据该簇内样品的平均年龄编号为1-5。
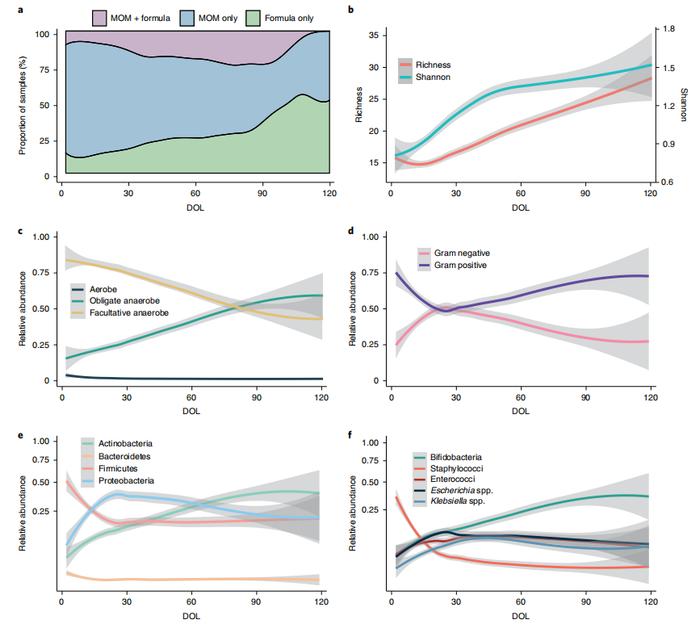
图1| 对早产儿出生前120天的饮食和肠道微生物群的描述性概述(n=1431)
2.塑造早产肠道微生物组的因素
抗生素、MOM、母乳强化剂(breast milk fortifier,BMF)和益生菌在一个或多个时间点与细菌分类显著相关(图2a)。益生菌在统计学上是最显著的,在所有时间点上都与细菌群落相关。对微生物组功能代谢能力的补充分析(complementary analysis)显示,在第10-14天、第25-29天、第30-34天、第35-39天和第50-69天,只有益生菌显著相关(图2b)。
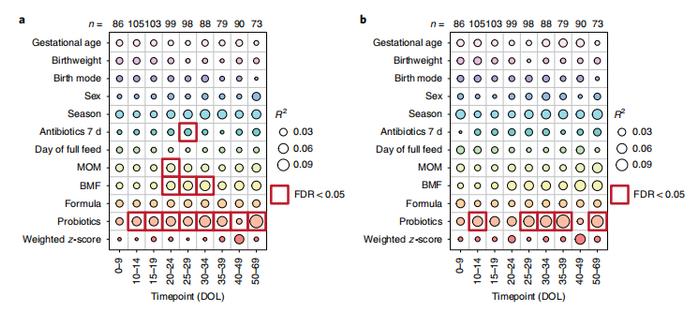
图2| 12个临床协变量在不同时间点的显著性和解释方差
3.益生菌在塑造肠道群落中的作用
二项混合效应模型显示,未接受益生菌的婴儿的肠道菌群更有可能过渡到富含克雷伯氏菌的PGCT-3,这与出生时较低的胎龄有关(图3a)。接受Infloran和接受Labinic的婴儿则更有可能分别过渡到PGCT-5和PGCT-4(图3a)。与不接受益生菌的婴儿相比,接受Labinic的婴儿的香农多样性和总体微生物组谱显著更高,进一步证明了不同益生菌的影响(图3c,d)。与从未接受益生菌治疗的DOL(day of life)匹配婴儿相比,在服用益生菌之前、期间和之后,益生菌种类明显更普遍(图3e)。根据分类图谱,在任何时间点上,益生菌是唯一与整体功能酶(Enzyme Commission,EC)概况显著相关的协变量(图2b)。益生菌组相互之间的差异比不服用益生菌组的分类组成更不同(图3d),与之不同的是,服用两种产品的婴儿的功能图谱比从未服用益生菌的婴儿的功能图谱更相似(图3f),无论使用哪种益生菌,其功能都是相似的。
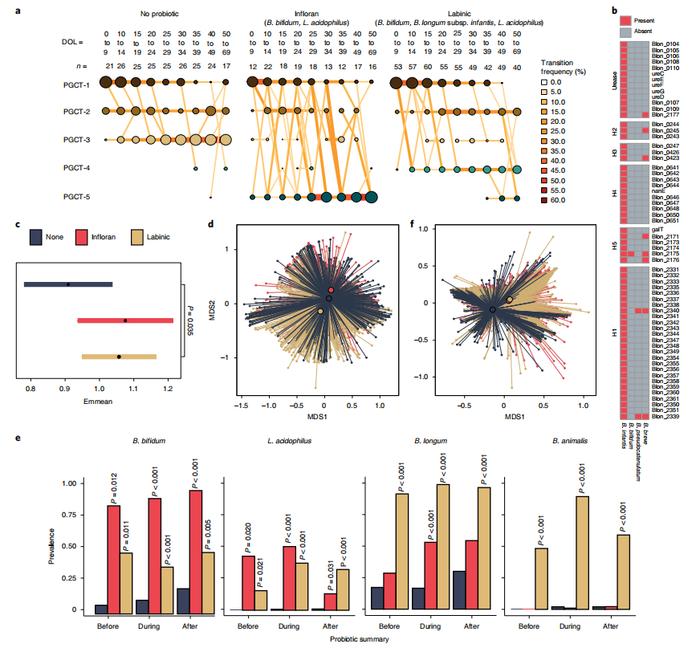
图3| 益生菌是与早产儿微生物组相关的最显著的协变量
4.非靶向代谢组学+转录组研究早产儿肠道微生物结构
PGCTs的总体组成存在显著差异(图4a)。为进一步探索PGCTs的功能影响,作者选择了代表每种PGCT的10个粪便样本的子集和匹配的血清样品进行非靶向代谢组学。结果发现,基于PGCT的样品之间的粪便代谢物谱存在显著差异(图4b),而相匹配的血清代谢物谱中则没有(图4c)。在粪便中发现,与PGCT-4/-5相比,PGCT-3中存在一种未知代谢物出现显著富集的情况(补充表5)。血清中,发现与PGCT-3相比,PGCT-4/-5中的一种代谢物溶血磷脂酰胆碱20:3显著富集(补充表6)。
为探索每种PGCT的小分子对早产儿上皮屏障功能的影响,采用了妊娠25周早产儿的肠道衍生类器官模型。来自类器官的转录组谱揭示了对每种PGCT粪便中上清液的特定宿主反应,PGCT-4和PGCT-5明显在x轴上聚集(图4d)。与培养基对照相比,PGCT-4-和PGCT-5暴露的类器官单层中显示出最多的差异表达基因(differentially expressed genes,DEG)(图4e),这进一步支持了这一点。通过GO分析对PGCT-4和PGCT-5暴露单层中上调的基因进行分组,发现这些DEG参与许多细胞和代谢过程,包括细胞蛋白代谢过程(补充表7)。
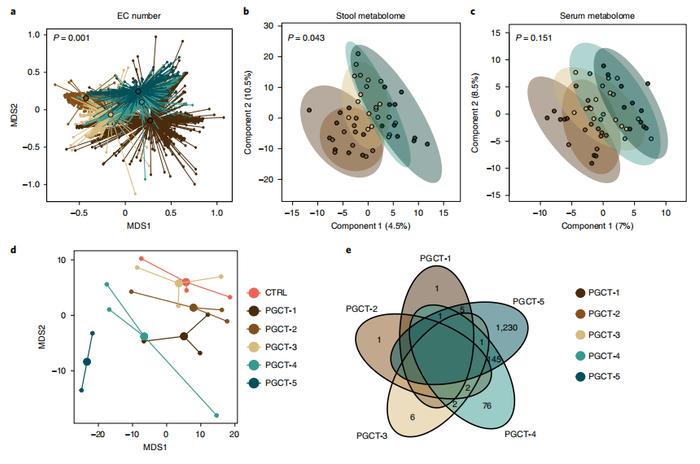
图4| 代谢组学研究早产儿肠道微生物结构
5.通过饮食和抗生素调节婴儿微生物组
与从未接受MOM相比,接受MOM后的香农多样性显著更高(图5a),并且在前7 d给予抗生素的样品中显著降低(图5b)。与从未接受过MOM的婴儿相比,在接受MOM期间和接受MOM之后采集的样品中,双歧杆菌的相对丰度显著较高。在接受MOM期间和之后收集的样品中,葡萄状球菌的相对丰度显著降低(图5c)。在接受抗生素治疗的婴儿中观察到相反的趋势,这些婴儿在前7天内接受抗生素,双歧杆菌的相对丰度出现显著降低而葡萄状球菌的相对丰度出现增加(图5d)。
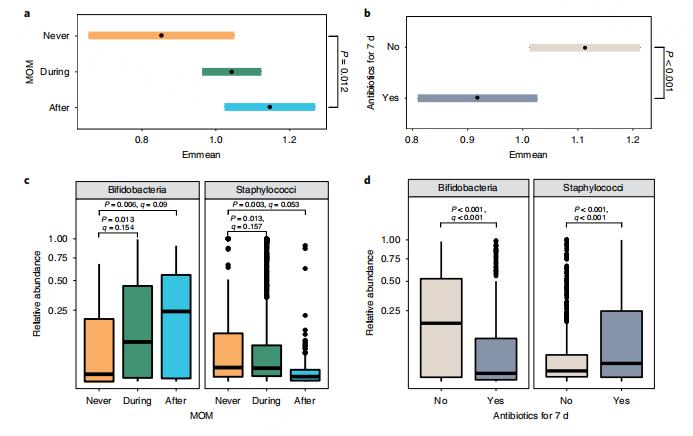
图5| MOM和抗生素与早产肠道微生物组显著相关
研究讨论
在大量纵向采样的早产儿群体中,益生菌产品的选择以不同的方式影响肠道微生物组的发育,加速其向双歧杆菌属的转变。此外,这些PGCTs在其功能含义和与宿主上皮的相互作用方面显示出差异。本项研究将有助于为设计针对早产儿肠道微生物组的干预试验提供支持。
小鹿推荐
该研究调查在离散时间段和使用益生菌之前使用的两种不同益生菌产品的影响。益生菌产品被确定为在分类和功能水平上塑造细菌群落的主要驱动力。结果表明补充Infloran或Labinic与过渡到两种不同的富含双歧杆菌的PGCT(PGCT-4和-5)有关,为了确定PGCT与宿主-微生物相互作用的相关性,对匹配的粪便和血清样本进行了代谢组学,并使用了实验性早产儿肠道类器官模型。发现粪便的代谢物谱与PGCT相关。此外,发现含有代谢物和粪便其他成分的无菌粪便上清液以PGCT特异性方式影响早产儿上皮反应。这表明在益生菌使用的驱动下,微生物组过渡到不同的PGCT具有相关的功能意义。
详细技术请访问鹿明生物官网
⬇
百度搜索鹿明生物(lumingbio)
⬇
了解更多多组学技术
(非靶向代谢组学、靶向代谢组学、代谢组学)
猜你还想看
1、Cancer Res | 转录组+空间代谢组学探究斑马鱼脂肪酸清除和甘油磷脂代谢为黑色素瘤治疗提供新思路
2、好文悦读 | 热心“肠”动态,空间代谢组学技术助力炎症性肠炎疗法开发新策略
3、项目文章 | 新鲜出炉!宏基因组+蛋白质组学探索红麻脱胶过程中相关的微生物群落变化
4、Ann Neurol | 神经科学一区TOP期刊,代谢组学为鉴别急性缺血性卒中与拟卒中提供相关诊断价值
本文系鹿明生物原创
转载请注明本文转自鹿明生物

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有

