前言
2022年10月31日,南京医科大学附属无锡人民医院检验医学科和临床研究中心团队于Cell Death Discovery( IF 6.350 )上在线发表了解析胶质母细胞瘤(GBM)替莫唑胺(TMZ)耐药机制的最新研究进展。作者利用家小鼠作为实验动物通过连续植入MGMT -高甲基化U87细胞构建了异种肿瘤移植模型,并分别使用低浓度的生理盐水和TMZ对模型进行连续治疗和肿瘤传代得到TMZ-S和获得性TMZ-R的GBM细胞。通过功能实验和单细胞测序进一步对TMZ-S和获得性TMZ-R的GBM细胞进行了差异解析,这将有助于揭示胶质母细胞瘤的替莫唑酰胺耐受机制并为临床肿瘤治疗提供新的思路。
欧易生物对该项目的单细胞转录组测序实验和分析工作提供了支持,单细胞测序结果揭示了TMZ-S和获得性TMZ-R的细胞异质性,并挖掘到了TMZ-R细胞群中一个特定的肿瘤干细胞亚群,为获得性TMZ-R的耐药机制提供了研究新思路。接下来,我们具体解析一下该项目的研究思路和实验内容。

基本信息
期刊:Cell Death Discovery
影响因子:6.350
发表年月:2022年10月
材料:The human GBM cell line U87,腹部被注射了U87的BALB/c雄性裸鼠,两天一次连续14天给予生理盐水的腹部肿瘤小鼠(TMZ-S),两天一次连续14天给予替莫唑胺的腹部肿瘤小鼠(TMZ-R),注射TMZ治疗的TMZ-S和TMZ-R小鼠(TMZ-S+TMZ/TMZ-R+TMZ)
方法:10x Genomics高通量单细胞转录组测序
研究背景
恶性脑胶质瘤是成年人中最常见的中枢神经系统原发瘤。多形性胶质母细胞瘤(Glioblastoma multiforme, GBM),以下称为GBM,是最易发生、来势最凶猛的一种原发脑瘤。现有的GBM常规治疗方案主要有手术、放射治疗和替莫唑胺(temozolomide,TMZ)给药辅助性化学治疗。替莫唑胺(TMZ)是一种口服烷基化剂,其细胞毒性是通过将DNA的O6鸟嘌呤甲基化为O6甲基鸟嘌呤进而诱导DNA交联实现的,最终将导致肿瘤细胞死亡。MGMT,O6-烷基鸟嘌呤-DNA烷基转移酶(O6-Alkylguanine-DNA alkyltransferase),对TMZ造成的肿瘤基因的损伤可进行直接修复,阻碍了TMZ化疗烷化剂对肿瘤细胞的杀伤,MGMT的活性和肿瘤的TMZ耐药性呈很强的正相关关系。MGMT在组织中的表达与其启动子甲基化状态呈负相关,MGMT基因启动子区域被甲基化会造成MGMT基因的沉寂,从而降低MGMT对TMZ化疗的抑制。临床研究发现,与非甲基化的病人相比,MGMT基因启动子甲基化的病人在TMZ治疗过程中会取得更好的治疗结果。
尽管TMZ治疗与MGMT基因启动子的甲基化和MGMT的表达有密切相关,但现有证据表明,在GBM进展和TMZ治疗期间,MGMT启动子甲基化状态和MGMT蛋白都保持相对稳定,同时MGMT-null GBM患者对TMZ的获得性耐药不太可能与MGMT的高表达相关,这意味着可能存在与MGMT无关的耐药机制。
为了揭示TMZ获得性耐药的机制,作者对小鼠进行了U87细胞(一种TMZ- null GBM细胞系)异种移植,通过三个周期的TMZ治疗和体内肿瘤传代,构建了获得性TMZ-耐药(TMZ- R)模型,通过单细胞RNA测序(scRNA-seq)分析持续TMZ治疗导致的细胞异质性,进一步阐明MGMT-null GBM患者产生TMZ-R耐药的原因,为细胞克服TMZ耐药性,恢复治疗反应提供良好的解决方案。
研究结果
Result1 获得性抗TMZ(TMZ-R) GBM异种移植模型的构建与确定
为了构建获得性的TMZ-R的GBM细胞,作者将U87细胞植入裸鼠体内,并使用低浓度TMZ对小鼠进行三个周期的TMZ治疗和肿瘤传代,同时以生理盐水治疗的小鼠作为对照,将从连续TMZ治疗的异种移植组织中分离出抗替莫唑胺的组织或细胞命名为TMZ- R,从生理盐水处理的异种移植组织中分离出的命名为TMZ-S(图1A)。
为了验证所构建TMZ-R模型的稳定性,作者进行了一系列的验证分析实验,包括生长速度的比较(图1B),实施TMZ治疗后各肿瘤细胞的生长速度比较(图1C),TMZ-R抗性模型和TMZ-S对照模型对多种抗癌药物的IC50分析(图1E),两种典型的多药耐药相关蛋白的编码基因ABCB1 (MDR1)和ABCC3在TMZ-R和TMZ-S细胞中的表达水平比较(图1F),以上实验的结果确定了所构建的获得性TMZ-R模型的稳定性,表明该模型可产生稳定的多药耐药衍生原代细胞以用于后续分析实验。
同时,作者利用DOX荧光分子结合流式细胞术发现TMZ-R对DOX摄取比TMR-S的摄取量低,表明组织的化学耐药性与药物摄取受损有关(图1G)。作者进一步分析了TMZ治疗对体内MGMT表达的影响,发现TMZ的持续治疗不会减少组织MGMT启动子的甲基化,这也进一步表明MGMT启动子甲基化/MGMT的高表达并不是组织产生TMZ抗性的原因。
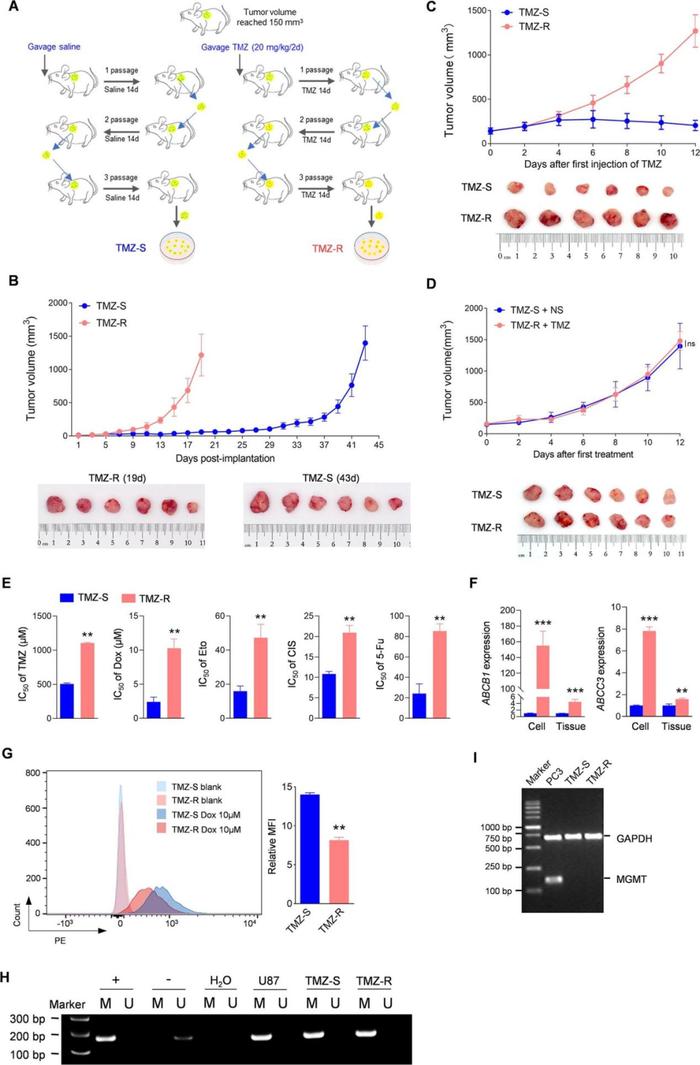
Result2 获得性TMZ-R组织中含有更多的静息态肿瘤干细胞
本研究发现与来自TMZ-S的原代细胞比,来自TMZ-R的原代细胞的增殖能力更弱(图2A, B)。EdU标记显示TMZ-R肿瘤细胞中的DNA复制进程显著减慢,且TMZ-R细胞中G0/G1细胞的比例显著增加(图2C,D,E),表明TMZ-R存在细胞周期阻滞。
通过比较肿瘤干细胞标记物CD133阳性(CD133+)细胞的数量和经典神经干细胞标记物的表达谱,证实了TMZ持续化疗会驱动组织干细胞的扩展(图2F,G)。在细胞三维球形培养实验中作者发现来自TMZ-R衍生的肿瘤干细胞 CSCs球扩增能力显著降低(图2I,H),同时人类肿瘤细胞增殖标记物Ki67在TMZ-R的CSCs中的表达也显著降低,在细胞中的分布也更稀疏(图2J,K),说明TMZ-R衍生出了更多处于静息态的肿瘤干细胞。
处于细胞周期阻滞的静息态肿瘤干细胞不仅可以躲过阻止细胞增殖、诱导细胞凋亡的肿瘤治疗手段,还会通过休眠产生耐药性,这被认为是肿瘤复发的主要原因。
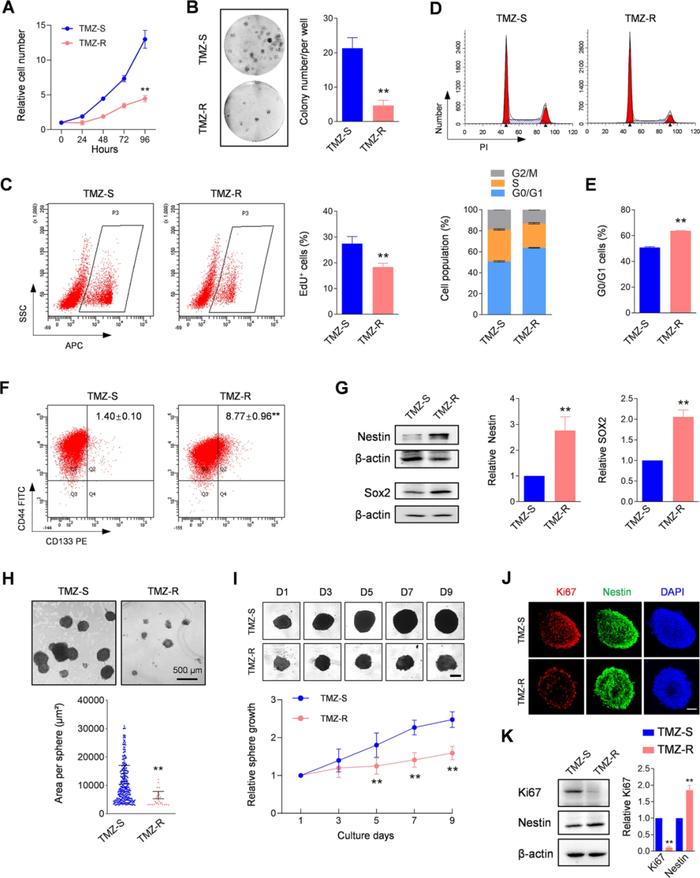
Result3 通过scRNA-seq鉴定了TMZ-R组织中的一个肿瘤干细胞亚群
作者对从TMZ-S和TMZ-R组织中分离出的样本进行单细胞RNA测序,在TMZ-S细胞文库中,捕获到18894个细胞,每个细胞平均有2776个基因。在TMZ-R细胞文库中,捕获到8627个细胞,每个细胞平均有3669个基因,这表明TMZ-R中的细胞基因转录发生了明显改变。
通过降维聚类,TMZ-R分成了11个不同的细胞群,TMZ-S分成了12个不同的细胞群。为了进一步探索耐药细胞的异质性和演化过程,作者进行了拟时序分析,与TMZ-S相比,TMZ-R衍生细胞的重建轨迹显示出更多的分支(图3A)。应用基因集变异分析(GSVA),作者对TMZ-R聚类的11个细胞群按照GO-BP进行富集分析,发现有6个细胞群与胶质瘤干细胞表达相关的基因上调,在这6个群中,C0、C2、C7对药物反应的相关基因下调且对ABC转运蛋白表达相关的基因上调(图B),与此同时,TMZ-S的10个细胞群中只有C8对药物反应下调,C5对转运蛋白表达上调,说明TMZ-R有着更低的药物反应和更强的药物排出能力,进一步解释了TMZ-R对药物的不敏感现象。
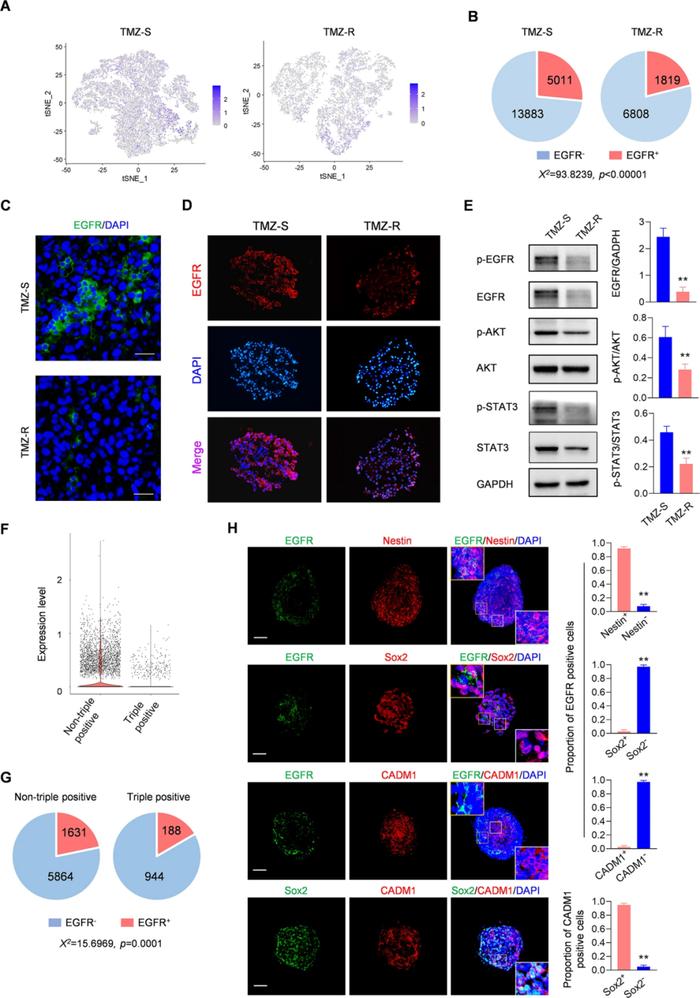
作者后续对TMZ-R中的C0、C2和C7集中进行了细胞鉴定。作者从人类细胞图谱数据库和现有文献中筛选了若干个人类脑癌干细胞标记物作为内参基因,采用qRT-PCR,在TMZ-R中筛选出表达上调的8个脑癌干细胞标记物,包括PROM1 (CD133)、SOX2、NES (Nestin)和CD44(补充图6),其中NES (Nestin)、SOX2和CADM1在C0、C2和C7中显著富集(图3C)。
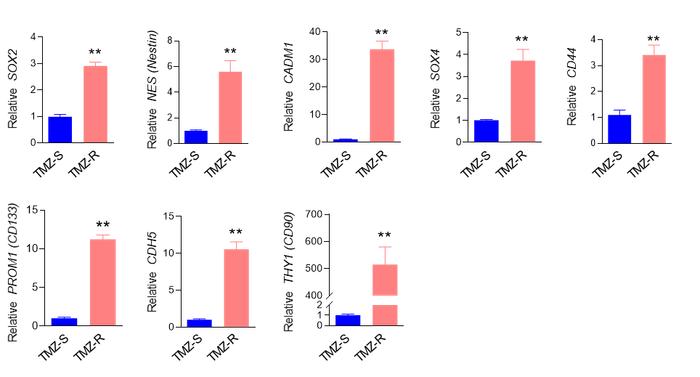
结合LOUPE发现在TMZ-R中NES 、SOX2和CADM1三个基因同时富集在了一个特定亚群,鉴定到了来自TMZ-R肿瘤的三阳性(SOX2+/CADM1+/NES+) CSC亚群(图3D),结合mIHC/IF染色,未在TMZ-S细胞中观察到三阳性细胞,进一步表明三阳性(SOX2+/CADM1+/NES+) CSC亚群是TMZ-R特有的(图3H, I)。进一步通过拟时序分析发现SOX2、CADM1和NES三阳性细胞在假定时间内的末端积累,以此推测TMZ的重复治疗会诱导细胞去分化(图3F)。在此基础上,作者结合GSVA评价三阳性细胞(SOX2+/CADM1+/NES+)和非三阳性细胞亚组的药物反应,发现三阳性细胞对药物反应显著下调,这可能与其ABC转运体活性增强有关(图3G)。
以上,通过单细胞测序分析揭示了持续的TMZ治疗诱导了细胞的多样性分化,并产生了一个独特的三阳性(SOX2+/CADM1+/NES+)肿瘤干细胞亚群,其对药物反应显著降低,这是TMZ-R细胞产生耐药性的主要原因。
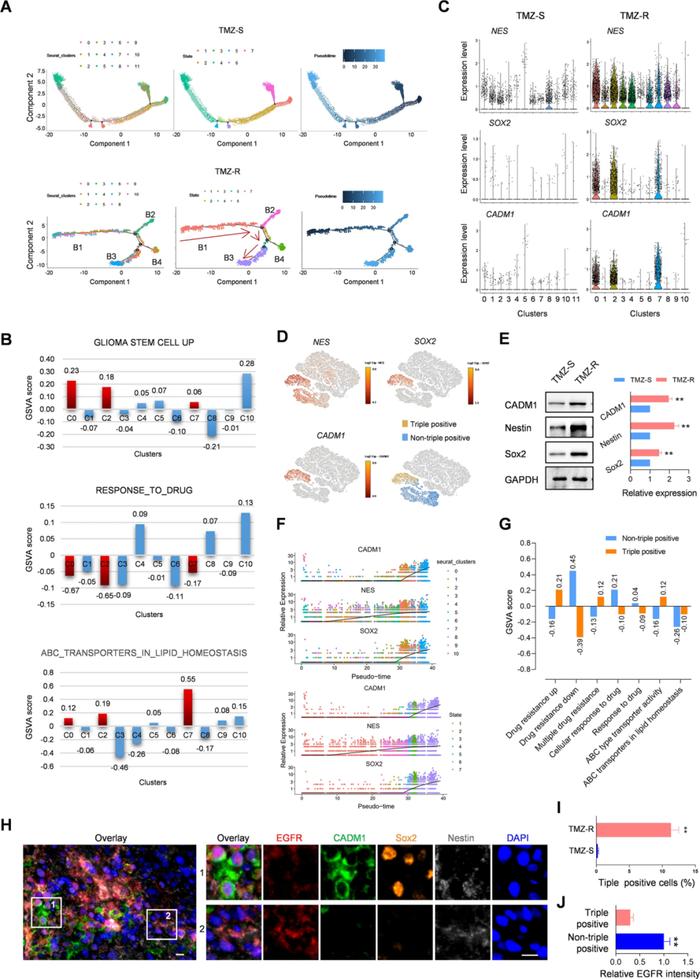
Result4 EGFR在特定的肿瘤干细胞亚群中的表达量显著降低
基于以上实验结果,我们了解到TMZ-R细胞有着相对较弱的增殖状态,同时衍生的CSCs大多处于静止状态,这暗示了TMZ-R干细胞培养基对营养因子的低响应。考虑到EGFR负责CSCs的维持和自我更新,作者推测TMZ-R衍生的CSCs可能只表达了少量的EGFR。通过LOUPE确定了EGFR在TMZ-R的分布较TMZ-S明显减少(图4A),同时TMZ-R中表达EGFR的细胞数量明显少于TMZ-S(图4B-D),Western blot试验进一步证实了TMZ-R肿瘤中EGFR的整体下调(图4E)。作者进一步检测了TMZ-R肿瘤的三阳性细胞中EGFR的表达,发现三阳性细胞的EGFR表达水平明显低于非三阳性细胞(图4F-J)。
综上所述,EGFR的缺乏是TMZ-R细胞静止状态的基础,且EGFR在三阳性肿瘤干细胞中显著缺乏。
Result5 EGFR缺乏将导致肿瘤干细胞CSCs细胞周期阻滞,可作为抗化疗耐药靶标
TMZ-R肿瘤来源的CSCs虽然仅表达少量EGFR,但仍能响应EGF的刺激产生应答(图5A),在EGF持续刺激下,TMZ-R肿瘤来源的CSCs的增殖能力得到了恢复(图5B-D),表明EGF促进了TMZ-R细胞恢复自我更新能力并诱导了细胞周期阻滞中静止细胞的释放。
作者进一步探索了EGF刺激是否有助于提高TMZ-R对药物的化学敏感性。IC50试验表明EGF处理提高了TMZ-R细胞对药物的化疗敏感性(图5E),结合流式细胞术进一步表明EGF处理能增强TMZ-R细胞对药物的吸收(图5F)。
基于以上的体外研究结果,作者通过对TMZ- R细胞异种移植模型采用TMZ和EGF联合治疗,确定EGF克服体内耐药的可行性。从肿瘤生长曲线(图5G)和最后一天采集的肿瘤的重量测定(图5H)结果可看出,单独使用EGF不会改变肿瘤的生长能力,但EGF+TMZ的联合治疗能显著抑制肿瘤生长。
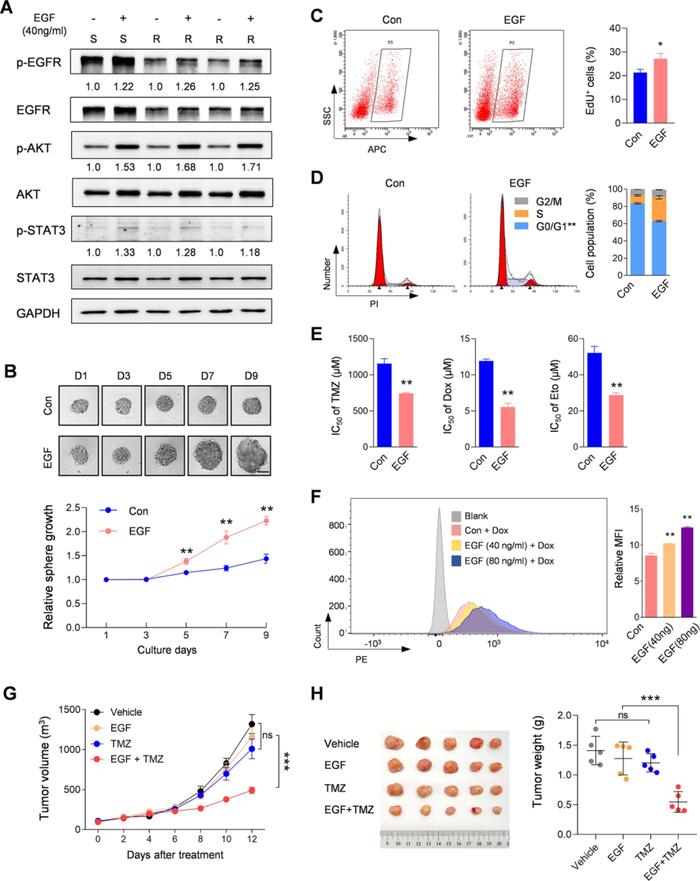
综上所述,本研究揭示了EGF的持续刺激能激活TMZ-R细胞恢复自我增殖,提高TMZ- R对肿瘤药物的敏感性。
研究结论
替莫唑胺(TMZ)耐药是胶质母细胞瘤(GBM)治疗的主要临床挑战,然而耐药细胞的进化过程尚不清楚,因此,解析细胞产生获得性耐药特性的机制对肿瘤的临床治疗尤为重要。在此研究中,作者构建了一个获得性TMZ耐药(TMZ-R)的异种移植模型,通过单细胞RNA测序(scRNA-seq)发现了在TMZ持续治疗下,通过强制表达神经干细胞转录因子(nanog, Sox2和Nestin),TMZ- R产生了细胞异质性,部分细胞系重编程形成了肿瘤干细胞,且大量的肿瘤干细胞存在细胞周期阻滞,处于静止状态。基于后续的单细胞测序分析在TMZ-R的CSCs中鉴定到了一个表达NES+/Sox2+/ CADM1+三阳性特征的CSCs,其表现出显著的耐药优势,这些具有耐药性的静息态肿瘤干细胞可能是获得性TMZ-R的GBM患者产生耐药的原因。进一步研究表明,表皮生长因子受体(EGFR)的缺乏和下游信号的减弱可能是导致三阳性CSCs具有耐药优势的主要原因,利用EGF进行持续治疗能机械逆转细胞周期阻滞,提高TMZ-R细胞对TMZ的化学敏感性,应用EGF+TMZ的联合治疗能使机体产生良好的TMZ药物反应。
综上,作者发现在MGMT缺失的生物环境中,EFGR活性的降低可能会引起肿瘤干细胞进入静止状态,使胶质母细胞瘤获得TMZ耐药特性。因此,在低MGMT表达或MGMT启动子高甲基化的患者中,EGFR信号的恢复可能会重新编程TMZ-R细胞,恢复患者的化疗敏感性。本研究揭示了胶质母细胞瘤的替莫唑酰胺耐受机制并为肿瘤治疗提供了新的思路。
详细技术请访问欧易生物官网
⬇
百度搜索欧易生物(oebiotech)
⬇
了解更多多组学技术
(单细胞RNA测序(scRNA-seq)、单细胞转录组测序、单细胞测序)
猜你想看
1、农林人注意了!这个农业科学研究激励活动我不允许你错过~
2、New Phytol | 北京农学院姚允聪团队再发miRNA调控苹果花青苷机制成果
3、Science 新技术!高通量微生物单细胞测序
4、特邀学术报告 | Nature最新文章研究思路分享:克隆野生玉米变异基因,有效提高玉米蛋白含量
原创声明:本文由欧易生物(OEBIOTECH)学术团队报道,本文著作权归文章作者所有。欢迎个人转发及分享,未经作者的允许禁止转载

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有

