
摘要
成体新生神经元参与记忆编码和消退,但其神经机制尚不清楚。我们发现4周龄的成体新生神经元会被学习行为招募并编码记忆,这一过程受到表观遗传的调控。同时,表观遗传的修饰降低了它们日后再次编码记忆的能力。在缺少特定表观遗传修饰的Suv39h1 KO小鼠中,实验结果显示学习行为招募的小鼠海马老年成体新生神经元数量的增加,小鼠学习任务的灵活性增加。除NRXN1外,我们还发现突触骨架蛋白SHANK1是Suv39h1调控记忆稳定性的主要靶点之一。Shank1的表达在学习过程中短暂地参与促进突触发生,并在学习5小时后被Suv39h1强烈抑制。在齿状回中外源性过表达Shank1会增加蘑菇样树突棘的密度,并损害原有记忆的稳定性。我们的研究表明,新生海马神经元通过活动依赖的表观遗传调控,参与区分了不同时间的经历,并稳定了旧记忆。
01
原文信息

02
主要内容
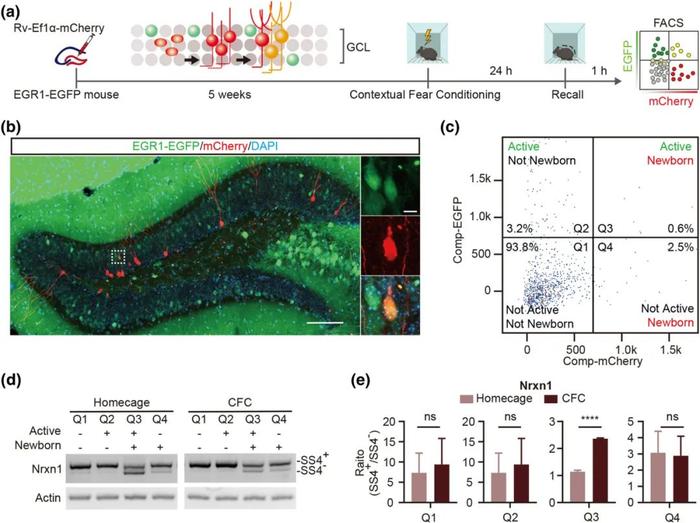
FIG1
学习引起海马体齿状回内新生神经元 Nrxn1 SS4 剪接包含率上升
研究人员首先在egr1-egfp小鼠内用逆转录病毒特异性标记DG内的新生神经元,egr1与c-fos类似,是一个常用的及早基因,兴奋的细胞会表达出egfp。小鼠脑内新生神经元在被逆转率病毒标记后,经过 5 周时间发育成熟,研究人员对小鼠进行一次场景恐惧记忆训练,并24 小时后进行一次回忆训练(图A)。1 小时后对小鼠海马体齿状回区域进行解剖、消化并做流式细胞分选。在流式细胞分选过程中,如图C所示,研究人员将消化后的单细胞悬液通过 仪器分到 4 个不同组分中,分别为 1. 非兴奋非新生神经元(Egr1-EGFP 阴性, mCherry 阴性),2. 兴奋的非新生神经元(Egr1-EGFP 阳性,mCherry 阴性),3. 兴奋的新生神经元(Egr1-EGFP 阳性,mCherry 阳性),4. 非兴奋的新生神经元 (Egr1-EGFP 阴性,mCherry 阳性)。研究人员发现,Homecage和CFC的两组小鼠,只有Q3组分(图D,E),也就是兴奋的新生神经元的Nrxn1 的可变剪接发生了显著变化,突触前膜黏附分子 Nrxn1 的可变剪接位点 4(SS4)的包含率上升表明神经元参与了学习并内在发生了分子表达上的改变。这表明兴奋的新生神经元在CFC的过程中参与了学习。
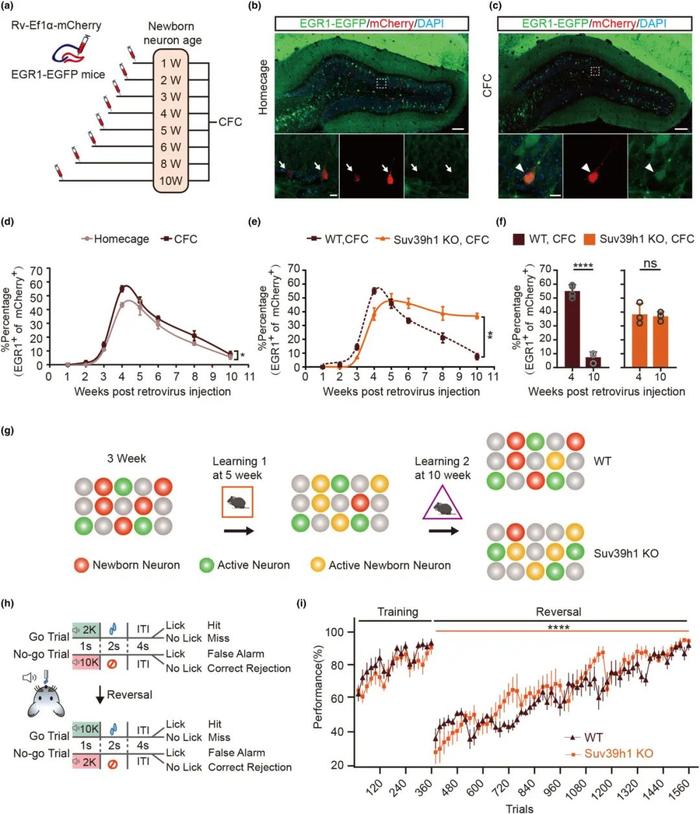
FIG2
表观遗传修饰调控兴奋的新生神经元群体参与不同时间的学习任务
进一步,研究人员推测如果新成熟的新生神经元更多的响应新的外界刺激而原先的成熟神经元只负责一些日常刺激,那么对于不同年龄的新生神经元其响应外界新刺激的水平是否存在一个规律?为此,研究人员同样也是通过逆转录病毒特异性标记Egr1-EGFP小鼠的海马体新生神经元,并在固定时间点进行训练学习并观察新生神经元群体的响应情况。发现,新生神经元随着其发育成熟的进行,无论是未经训练的homecage组与进行场景恐惧记忆训练的CFC组,其新生神经元中Egr1-EGFP阳性细胞的比例随着时间有一个先上升后下降的动态变化。其响应外界刺激的能力有着一个动态变化(图D)。成熟的新生神经元可能会在受到一次或几次外界刺激激活后逐渐趋向于一个不可被招募,对外界新刺激逐渐不做出响应的状态。即新生神经元发育成熟至4-5周,接受外界刺激并发放,作为记忆印记细胞承载一部分信息后,会逐渐趋归于沉默。而随着动物脑内新生神经元源源不断地产生,特定时间段产生的并发育成熟的新生神经元会负责记录相应时间段内的事件,在这之后的事件则更多的由之后发育成熟的新生神经元负责响应并记录。
进一步,为了探究造成新生神经元在成熟后期对外界刺激响应程度逐渐下降的机制,研究人员在Suv39h1全身性敲除的小鼠中,按照相同时间点重复了新生神经元标记并训练的实验,Suv39h1本身是作为维持记忆稳定存在的表观分子,已有报道对动物记忆的稳定性有重要作用。结果如图E所示。在Suv39h1敲除的小鼠中,其新生神经元在成熟后期仍能够维持较高的发放比例,表明其很有可能持续参与新的学习任务。从而研究人员不难推测其新生神经元可能由于缺乏Suv39h1这样能稳定记忆,降低突触可塑性的抑制性表观修饰因子,从而导致其新生神经元的即使在成熟后期也维持着较高的突触可塑性,进一步可能导致小鼠本身记忆稳定性受损,因为其缺乏对于旧的记忆的保护机制。
同时,在Go-Nogo行为实验中,由于Suv39h1敲除小鼠的记忆稳定性受损,其在反转学习阶段,表现出更好的学习水平(图H,I)。
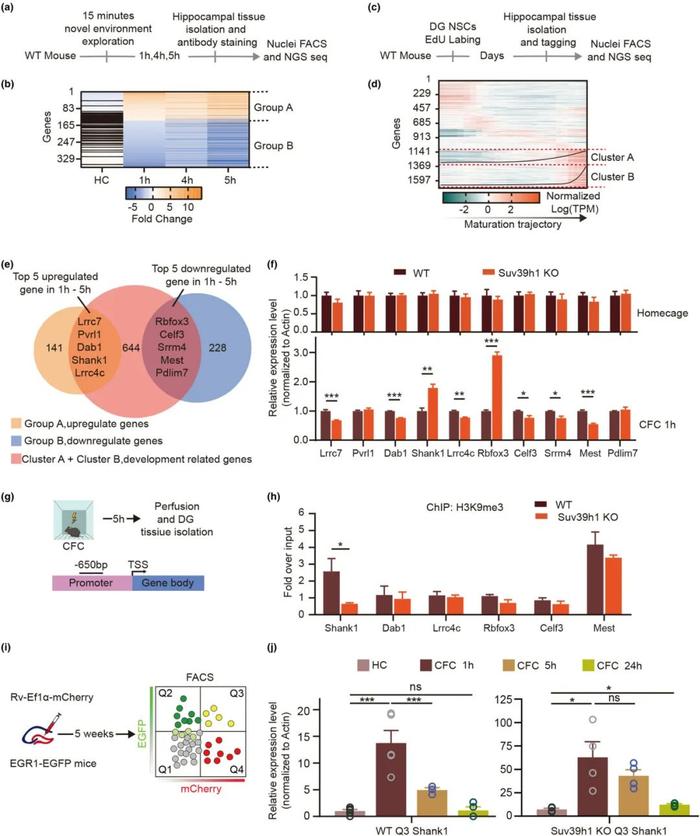
FIG3
通过测序数据筛选发现shank1在神经元中的表达受活动激活并受到Suv39h1调控
研究人员通过调研公开的海马单细胞测序数据库,发现了数十个受神经元活动调控并在发育过程中随发育程度有显著变化的基因,并对他们做了进一步筛选(图A-F)。最终通过ChIP实验发现(图G,H),在训练后5h,在突触后膜骨架蛋白Shank1基因的Promoter区,WT的H3K9me3甲基化富集程度要显著高于KO组,表明Suv39h1可能对Shank1基因存在直接的修饰作用,Shank1可能是组蛋白甲基转移酶Suv39h1(负责H3K9的三甲基化)的直接下游。
最后为了更精确的观测新生神经元中是否是Suv39h1在学习过程中调控Shank1的表达研究人员通过逆转录病毒标记和流式分选的方法,在学习前后不同时间,分别在wt 和Suv39h1KO小鼠中,取激活的新生神经元做表达分析,结果如下。结果表明在学习的1个小时后shank1的表达有显著上升,然后5h后下降,然后在suv39h1 KO的小鼠中,标记的新生神经元在学习后他的shank1的表达有一个显著的上升,数值要远高于wt组,同时他的5h表达量也没有一个显著的下降,这些结果都表明,新生神经元中shank1的表达是活动依赖的同时suv39h1直接参与调控抑制shank1的表达。
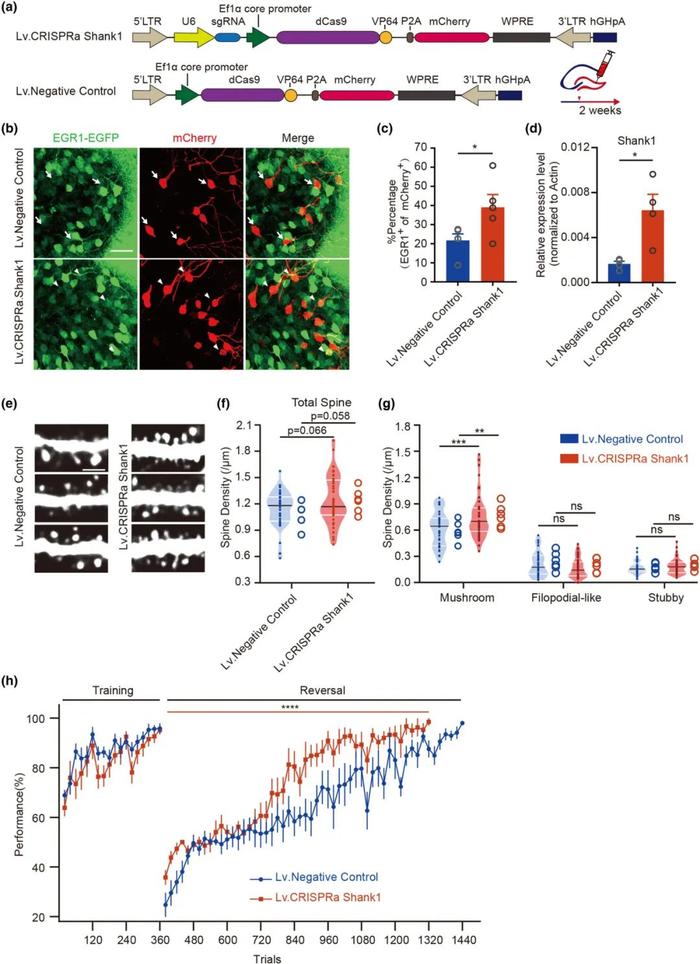
FIG4
提高Shank1表达引起小鼠海马体齿状回神经元蘑菇样突触数量增加并影响记忆稳定性
首先,研究人员通过慢病毒介导的CRISPR activation 系统来提高小鼠神经元内Shank1的表达(图A)。在过表达Shank1的海马神经元中,Egr1-EGFP阳性细胞的比例有显著上升(图C)。进一步,研究人员对小鼠海马体齿状回神经元的突触结构进行了观察分析。结果发现(图E,F,G),Shank1的表达对于蘑菇样突触的数量有促进作用。而这种成熟状态的蘑菇样突触相较于未成熟的丝足状突触,被报道对长期记忆的维持有重要作用,说明Shank1对于记忆的形成与稳定可能存在重要作用。为此,研究人员通过Go/No-Go舔水行为实验验证了这一猜想。如图H,在反转学习阶段,当原先的学习范式被调转后,过表达Shank1的小鼠的学习速度要显著高于对照组,其表现比对照组更快地超过80%的限定标准。这种在反转学习中表现上升的情况与Suv39h1敲除小鼠类似,说明当野生型小鼠海马体齿状回过表达Shank1之后,其记忆的稳定性受损,从而能更快的忘记之前习得的行为范式,被后续的任务信息所覆盖。
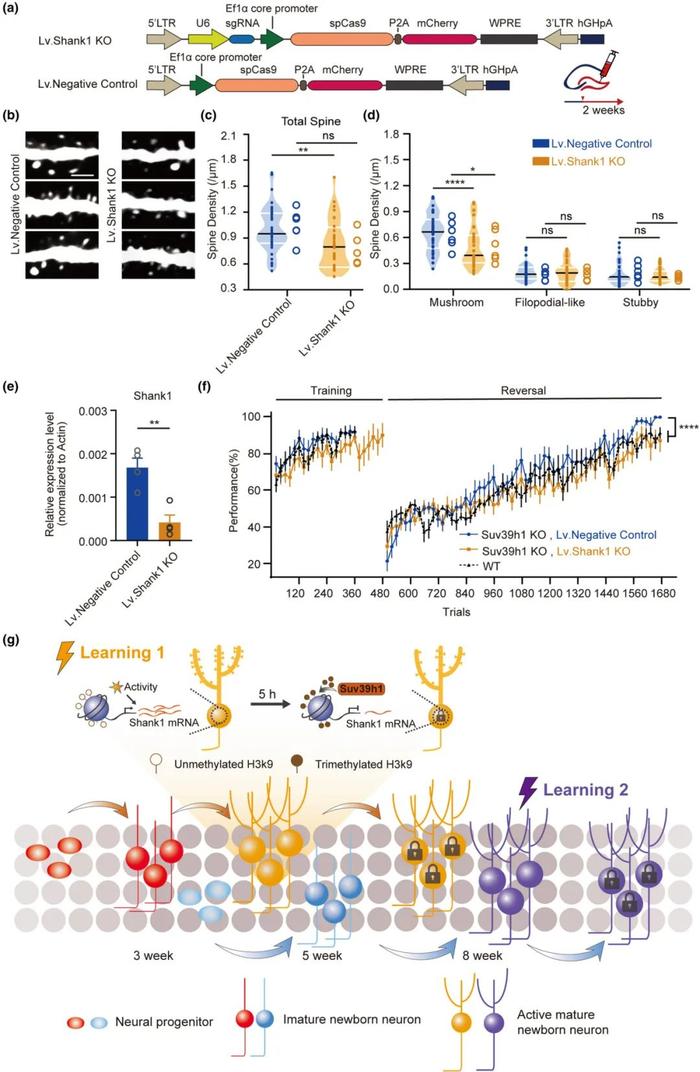
FIG5
降低Shank1表达引起小鼠海马体齿状回神经元蘑菇样突触数量减少并影响记忆稳定性
由于Shank1的表达本身受到Suv39h1的抑制,所以在先前Suv39h1敲除小鼠的舔水训练实验中,其在反转学习阶段表现上升的现象,很有可能是由异常高表达的Shank1造成,为了进一步确认从分子到行为的直接因果关系。研究人员在Suv39h1敲除的小鼠中,再降低Shank1的表达,进而判断Shank1是否直接导致了Suv39h1敲除小鼠在舔水行为中的表现。在这个实验中,研究人员通过慢病毒介导的CRISPR-Cas9系统来降低小鼠齿状回中神经元Shank1的表达(图A)。
Shank1体内敲除实验结果显示,降低神经元内Shank1的表达,将会显著降低神经元蘑菇样突触的数量(图B,C,D)。同时在Go/No-Go舔水行为实验中,在反转学习阶段,降低了Shank1表达的Suv39h1敲除小鼠其表现要显著低于打了对照病毒的Suv39h1敲除小鼠,其反转学习的速度与之前的野生型小鼠相比没有明显差距(图E)。由此可以确定,Suv39h1敲除小鼠在反转学习过程中相较于野生型小鼠有较快的学习速度,最直接的原因是过度表达的Shank1导致的记忆稳定性受损,使得原先的正向学习记忆容易被后续反转的新信息所覆盖。这个结果也进一步明确了Shank1在维持细胞大突触例如蘑菇样突触的数量,维持生物体记忆稳定性方面有重要作用。


财经自媒体联盟

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有


















































 第一财经日报
第一财经日报  每日经济新闻
每日经济新闻  贝壳财经视频
贝壳财经视频  尺度商业
尺度商业  财联社APP
财联社APP  量子位
量子位  财经网
财经网  华商韬略
华商韬略