胆管细胞癌是一种侵袭性的胆管癌症,可发生在肝内和肝外。大约20%的患者为肝内形式,其中,10%至16%的患者具有FGFR2基因重排,包括促进肿瘤增殖的融合。FGFR的抑制即抑制了肿瘤生长所必需的各种下游途径。
三种FDA批准的FGFR抑制剂
目前在美国有两种可供选择的FGFR抑制剂已被批准用于该亚群,Incyte的Pemazyre(pemigatinib)和QED Therapeutics的Truseltiq(infigratinib)。现在,据Taiho称,Lytgobi在FDA的实时肿瘤学审查(RTOR)试点下进行了评估,并因其令人可喜的总体应答率和应答持续时间而获得了加速批准。
Taiho公司是于9月30日发布新闻稿称,美国食品和药物管理局(FDA)已加速批准Lytgobi(futibatinib)用于治疗具有成纤维细胞生长因子受体2(FGFR2)基因融合或其他重排的先前治疗、不可切除、局部晚期或转移性肝内胆管细胞癌的成年患者。
该药物此前曾获得FDA的突破性、孤儿药和优先审查指定。在加速批准途径下,对该适应症的继续批准可能取决于验证性试验中对临床益处的验证和描述。
Lytgobi是一种口服、选择性和不可逆的FGFR 1、2、3和4小分子激酶抑制剂。它与FGFR2共价结合,抑制信号通路并降低癌细胞系中FGFR改变的细胞活力。
新FGFR抑制剂与另两种有何不同
Taiho认为,Lytgobi的作用机制(MOA)使其与竞争药物不同。虽然Pemazyre和Truseltiq是可逆的ATP竞争性抑制剂,但Lytgobi与FGFR共价且不可逆地结合,从而更长时间地抑制FGFR相关的信号通路。
然而,安全问题仍然是这类药物的一个问题,眼睛毒性、高磷血症和胚胎-胎儿毒性的警告被列为使用Lytgobi的风险。
Lytgobi的疗效及安全性
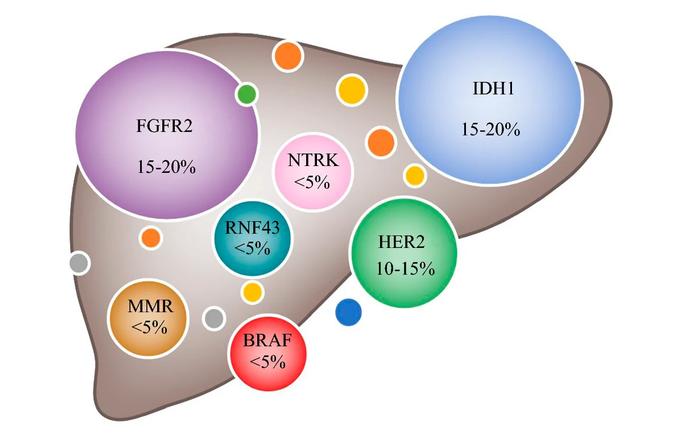
该批准基于非盲、单臂2b期TAS-120-101试验(NCT02052778)的数据,该研究在103名患有先前治疗的、不可切除的、局部晚期或转移性肝内胆管细胞癌且具有FGFR2基因重排,包括融合的成人中评估了futibatinib。患者每天口服一次futibatinib 20mg,直至疾病进展或出现不可接受的毒性。
结果显示总体应答率(ORR)为42%(主要终点;[95%CI,32-52]);所有43名应答者都有部分应答。中位缓解持续时间(中位DOR,次要终点)为9.7个月(95%CI,7.6-17.1);72%(n=31)的应答者的应答持续至少6个月,而14%(n=6)的应答持续至少12个月。中位应答时间为2.5个月(范围0.7-7.4个月)。
报告的最常见不良反应是指甲毒性、肌肉骨骼疼痛、便秘、腹泻、疲劳、口干、脱发、口腔炎、腹痛、皮肤干燥、关节痛、味觉障碍、干眼症、恶心、食欲下降、尿路感染、掌跖红肿综合征和呕吐。
参考来源:‘FDA Approves Taiho’s LYTGOBI® (futibatinib) Tablets for Previously Treated, Unresectable, Locally Advanced or Metastatic Intrahepatic Cholangiocarcinoma’,新闻。Taiho Oncology, Inc.;2022年9月30日发布。
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指引,请咨询主治医师。

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有

