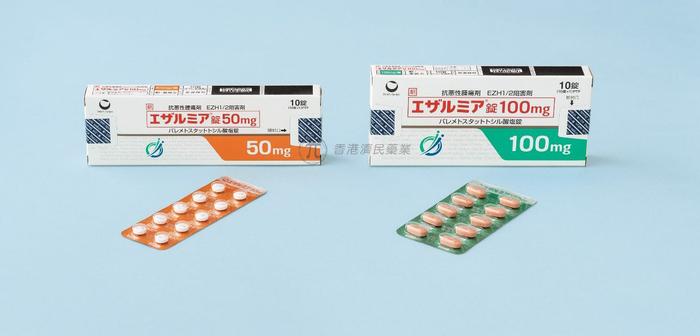
第一三共制药的EZH1/2双重抑制剂EZHARMIA在日本获得了第二个适应症批准,用于治疗复发或难治性外周T细胞淋巴瘤(PTCL)成人患者。
外周T细胞淋巴瘤是一组罕见且通常具有侵袭性的血癌,约占所有非霍奇金淋巴瘤(NHL)的10%至15%。与世界其他地区相比,外周T细胞淋巴瘤在亚洲更为常见。大多数患者在采用基于多药化疗的方案进行初始治疗后会出现疾病进展,复发后的中位总生存期约为5.8个月。目前,对于复发或难治性疾病患者,可用的治疗选择有限。
EZHARMIA(valemetostat tosilate,甲苯磺酸伐美妥司他)是全球首个获得批准用于该适应症的双重EZH1和EZH2抑制剂,EZH1/2是参与基因表达的酶。Valemetostat被认为通过抑制EZH1/2的甲基化活性来表现出肿瘤生长抑制作用,EZH1/2反过来又抑制组蛋白H327位赖氨酸残基的甲基化。然而,详细的作用机制尚未阐明。
此前,日本厚生劳动省根据一项关键2期试验(NCT04102150)的结果,于2022年9月批准了该药物用于治疗复发/难治性成人T细胞白血病患者。目前,该药物仅在日本获批上市,在其他国家仍在试验阶段。
EZHARMIA新适应症的批准基于全球、开放标签、单组、两队列VALENTINE-PTCL01(NCT04703192)2期试验的结果,该试验结果已在2023年美国血液学会(ASH)年会上公布。
该试验评估了EZHARMIA在复发或难治性外周T细胞淋巴瘤和成人T细胞白血病/淋巴瘤患者中的疗效和安全性,这些患者之前至少接受过一种全身治疗,并且在筛选时不符合造血干细胞移植的条件。患者每日一次空腹口服该药物200mg。
试验分为成人T细胞白血病/淋巴瘤患者队列和外周T细胞淋巴瘤患者队列。在外周T细胞淋巴瘤患者队列中,纳入了来自欧洲、亚洲、北美洲和大洋洲的多个地区的共133名患者。
该试验的主要终点是客观缓解率(ORR),次要终点是缓解持续时间、完全缓解(CR)、部分缓解(PR)、完全缓解持续时间、无进展生存期、总生存期、安全性和药代动力学。
在VALENTINE-PTCL01中,通过基于CT的盲法独立中心审查(BICR)评估,119名可评估疗效的复发或难治性外周T细胞淋巴瘤患者中观察到EZHARMIA的客观缓解率(ORR)为43.7%(n=52,95%CI:34.6-53.1)。观察到17例完全缓解和35例部分缓解。多种外周T细胞淋巴瘤亚型均出现缓解,包括血管免疫母细胞性T细胞淋巴瘤、未另行指定的外周T细胞淋巴瘤和其他外周T细胞淋巴瘤亚型。
该试验中EZHARMIA的安全性与既往的临床试验一致。133名患者中有106名(79.7%)发生了治疗相关不良事件,最常见的包括血小板计数减少(44.4%)、贫血(27.1%)、味觉障碍(24.8%)和中性粒细胞计数减少(21.1%)。
参考来源:‘EZHARMIA® Approved in Japan as First Dual EZH1 and EZH2 Inhibitor Therapy for Patients with Peripheral T-Cell Lymphoma’,新闻稿。Daiichi Sankyo;2024年6月24日发布。
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指导,请咨询主治医师。

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有

