在美国已被批准用于治疗某些弥漫大B细胞淋巴瘤的艾伯维药物epkinly获得了第二个适应症批准,其新适应症与罗氏的Lunsumio类似,后者于2022年底获得了三线滤泡型淋巴瘤治疗的批准。这两种药物都是CD20xCD3双特异性T细胞接合剂。
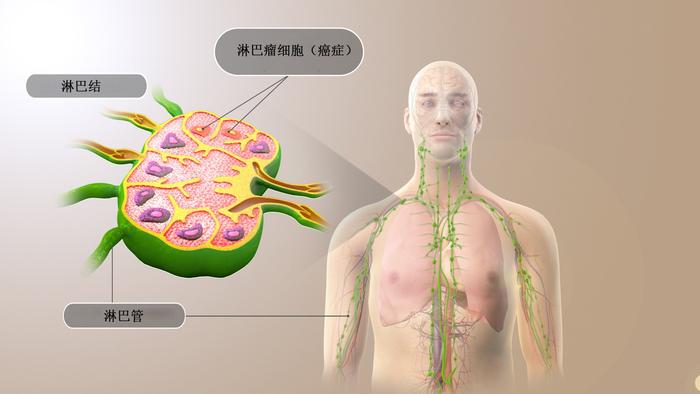
美国FDA对epkinly(epcoritamab-bysp,艾可瑞妥单抗)的批准为加速批准,用于治疗已接受过二线或以上治疗的复发或难治性滤泡型淋巴瘤(FL)成人患者。该适应症基于总缓解率(ORR)和缓解持续时间(DOR)数据,持续批准可能取决于验证性试验中的临床益处的验证和描述。
滤泡型淋巴瘤是典型的惰性形式的非霍奇金淋巴瘤,起源于B淋巴细胞。患者经常复发,每次复发后,缓解期和下次治疗的时间都会缩短。随着时间的推移,超过25%的患者可能会转化为弥漫大B细胞淋巴瘤,这是一种侵袭性非霍奇金淋巴瘤类型。
根据美国国家癌症研究所的说法,双特异性T细胞接合剂(BiTE)是一种结合不同细胞上两种靶蛋白的物质,如健康T细胞(免疫细胞)和癌细胞上的蛋白,以帮助破坏癌细胞。
艾伯维在其新闻稿中强调,epkinly现在是美国批准用于治疗两类复发或难治性淋巴瘤的首个双特异性抗体。该药物在日本和欧盟也获批用于治疗某些淋巴瘤,在欧盟名为Tepkinly。
针对弥漫大B细胞淋巴瘤,相应的罗氏也有另一种CD20xCD3药物——Columvi。
与静脉输注给药的Lunsumio相比,epkinly具有皮下注射的优势。不过Columvi和Lunsumio具有给药固定持续时间,患者在几个周期后停止治疗。相比之下,epkinly的给药时间是无限期的,直到病情进展或出现不可接受的毒性。而作为现成的现成疗法,epkinly和Lunsumio比CD19 CAR-T疗法更容易获得。
FDA对epkinly此次加速批准基于1/2期EPCORENHL-1(GCT3013-01;NCT03625037)研究,该研究纳入了接受过至少两种全身治疗后的复发或难治性滤泡型淋巴瘤患者。
患者按照2步递增剂量方案接受epkinly单药治疗:
•第1周期:第1天0.16mg,第8天0.8mg,第15天和第22天48mg;
•第2-3周期:第1、8、15和第22天48mg;
•第4-9周期:第1天和第15天48mg;
•第10周期及以后:第1天48mg。
患者持续接受epkinly治疗直至病情进展或出现不可接受的毒性。
该研究的主要疗效和安全性分析基于127名患者的关键2步剂量递增方案队列。另一个由86例患者组成的剂量优化队列评估了为缓解细胞因子释放综合征(CRS)而推荐的3步递增剂量方案。3步递增剂量方案与2步区别在于第1周期给药方案为第1天0.16mg,第8天0.8mg,第15天3Mg,第22天48mg。
该研究结果显示,接受epkinly治疗的患者总缓解率为82%,其中60%实现完全缓解,22%实现部分缓解。超过一半对治疗有缓解的患者在中位14.8个月的随访中仍然有缓解。12个月时持续缓解的患者有68.4%。患者首次缓解的中位时间为1.4个月(范围:1至3个月)。剂量优化队列的疗效结果与主要疗效人群相当。
根据处方信息,epkinly携带有严重或致命的CRS和免疫效应细胞相关神经毒性(ICANS)的黑框警告。6%的患者发生ICANS,40%的患者发生严重感染。在接受3步递增剂量方案的86名患者中,49%的患者发生CRS,其中所有事件均为1级(45%)或2级(9%),即严重程度为轻度至中度。
注射部位反应、细胞因子释放综合征和Covid-19是试验中报告的最常见不良反应。
Epkinly的疗效数据与Lunsumio的GO29781试验的结果非常相似,后者记录的ORR为80%,完全缓解率为60%。对有缓解的患者进行中位随访14.9个月后,中位缓解持续时间为22.8个月。
参考来源:‘U.S. Food and Drug Administration Grants Second Approval for EPKINLY® (epcoritamab-bysp) to Treat Patients with Relapsed or Refractory Follicular Lymphoma’,新闻稿。AbbVie;2024年6月26日发布。
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指导,请咨询主治医师。

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有

