礼来公司表示,donanemab在阿尔茨海默病的TRAILBLAZER-ALZ 2(NCT04437511)3期试验中达到了主要终点和所有次要终点。在晚期试验中,该药物显著减缓了早期症状性阿尔茨海默病患者的认知和功能衰退。
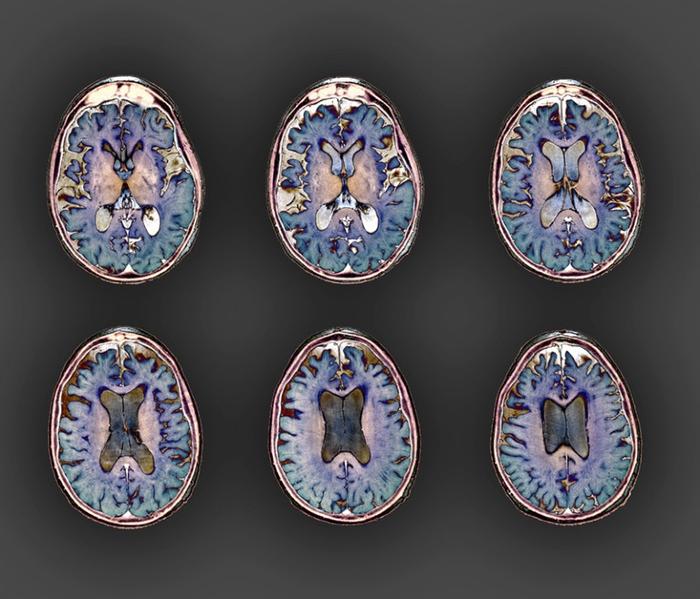
3种阿尔茨海默病药物
Donanemab是一种静脉输注地研究性淀粉样斑块靶向治疗,旨在靶向并破坏阿尔茨海默病患者大脑中形成的淀粉样蛋白斑块。它与FDA于2021年批准的Biogen的ADUHELM(aducanumab-avwa)和该机构今年早些时候批准的卫材的LEQEMBI(lecanemab-irmb)属于同一类疗法。后两种药物在较小程度上减缓了认知能力衰退。
今年1月,FDA拒绝了礼来提出的加快批准donanemab的申请,并要求该公司提供至少连续12个月随访的至少100名患者的数据。礼来公司表示,因为一旦斑块清除,患者就停止了donanemab的给药,许多研究参与者能够最早在6个月内停止接受该药物,这使得该公司未能达到FDA设定的患者数量阈值。
而现在3期研究补充了这些所需数据,这重新燃起了该疗法可为神经退行性疾病提供另一种新治疗选择的希望。

Donanemab达3期研究终点
TRAILBLAZER-ALZ 2是一项随机、双盲、安慰剂对照试验。其目的是评估donanemab在1736名年龄在60至85岁患有早期症状性阿尔茨海默病(包括轻度认知障碍或轻度痴呆,并存在确诊的阿尔茨海默病神经病理学)的成人中的疗效和安全性。
在试验中,患者在达到预定的淀粉样斑块清除水平后,则完成了donanemab的治疗过程。
该研究的主要终点是综合阿尔茨海默病评定量表(iADRS)从初始到18个月的变化。据礼来称,iADRS衡量日常生活活动和认知,如财务管理、驾驶车辆、兴趣爱好以及讨论时事。
次要终点包括认知和功能衰退,该药物在统计学上具有高度实质性的临床益处。
在主要分析人群中,iADRS的主要终点表明衰退速度减慢了35%,而临床痴呆评分箱(CDR-SB)的关键次要终点表明在18个月内衰退速度减慢了36%。
此外,额外的预先指定的二次分析显示,47%的接受donanemab治疗的患者在一年时CDR-SB没有下降。
此外,TRAILBLAZER-ALZ 2试验显示,使用donanemab的受试者在18个月时进行日常生活活动的能力下降减少40%。与安慰剂相比,患者进入疾病下一阶段的风险也降低了39%。
在安全性方面,donanemab具有同类药物的已知并发症发生率——淀粉样蛋白相关的影像学异常(ARIA)、脑肿胀和出血等事件。在24%接受治疗的患者中观察到脑肿胀,而在31.4%的患者中报告有出血并发症。礼来表示,该研究中,严重ARIA的发生率为1.6%,包括3例死亡。
这些初步研究结果尚未经过外部专家的评审。礼来公司计划在今年7月的阿尔茨海默病协会国际会议上公布完整的研究结果,并正在寻求美国FDA对该药物的批准。
参考来源:‘Lilly's Donanemab Significantly Slowed Cognitive and Functional Decline in Phase 3 Study of Early Alzheimer's Disease’,新闻发布。Eli Lilly and Company;2023年5月3日发布。
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指引,请咨询主治医师。

4000520066 欢迎批评指正
All Rights Reserved 新浪公司 版权所有

